Уведомления
Авторизуйтесь или зарегистрируйтесь, чтобы оценивать материалы, создавать записи и писать комментарии.
Авторизуясь, вы соглашаетесь с правилами пользования сайтом и даете согласие на обработку персональных данных.
Теломеры: невнятный секрет долголетия
Наверное, еще с того момента, как первые наши прапрапредки обрели сознание, человек боялся смерти и искал пути ее предотвратить или отсрочить. Древний человек жаждал утешения в представлениях о загробном мире, позже алхимики пытались изобрести зелья, которые помогли бы достичь бессмертия. С развитием науки ученые стремились понять, как работает наша смертность на клеточном уровне и еще глубже – и можно ли серьезно изменить отмеренный человеку век. Именно о теломерах часто говорят как о некоем секрете долголетия, том самом волшебном рычаге в ДНК, который может прибавить один-два десятка лет к нашей жизни. Так ли это?
Что такое теломеры
ДНК эукариотов (организмов, все клетки которых имеют ядро – в отличие от прокариотов, такового не имеющих) состоит как из кодирующих, так и из некодирующих участков. Причем первых гораздо меньше, чем вторых. Это, впрочем, вовсе не странно, ведь многоклеточный организм – структура чрезвычайно сложная, и для его регуляции требуется очень много данных. Теломеры выполняют одну из таких регуляционных функций: они определяют возраст клетки. И здесь стоит уточнить: этот возраст – не то время, которое клетка просуществовала.
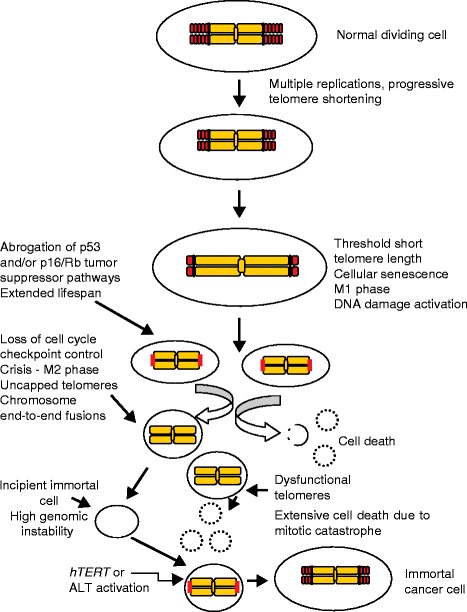
Сама по себе теломера – структура чрезвычайно простая. Это концевые участки хромосом, которые содержат в себе повторяющийся нуклеотидный паттерн. У большинства животных он выглядит как TTAGGG (буквы обозначают нуклеотиды: тимин, аденин, гуанин соответственно). Такие последовательности, как уже было написано выше, ничего не кодируют. Их роль можно назвать жертвенной. При каждом новом делении клетки ее генетический материал копируется. За это отвечает целый комплекс ферментов, которые расплетают, стабилизируют и воспроизводят нити ДНК, а также формируют затравки-праймеры. Центральную роль здесь играет ДНК-полимераза, которая синтезирует новую цепь нуклеиновой кислоты, используя существующую в качестве матрицы.
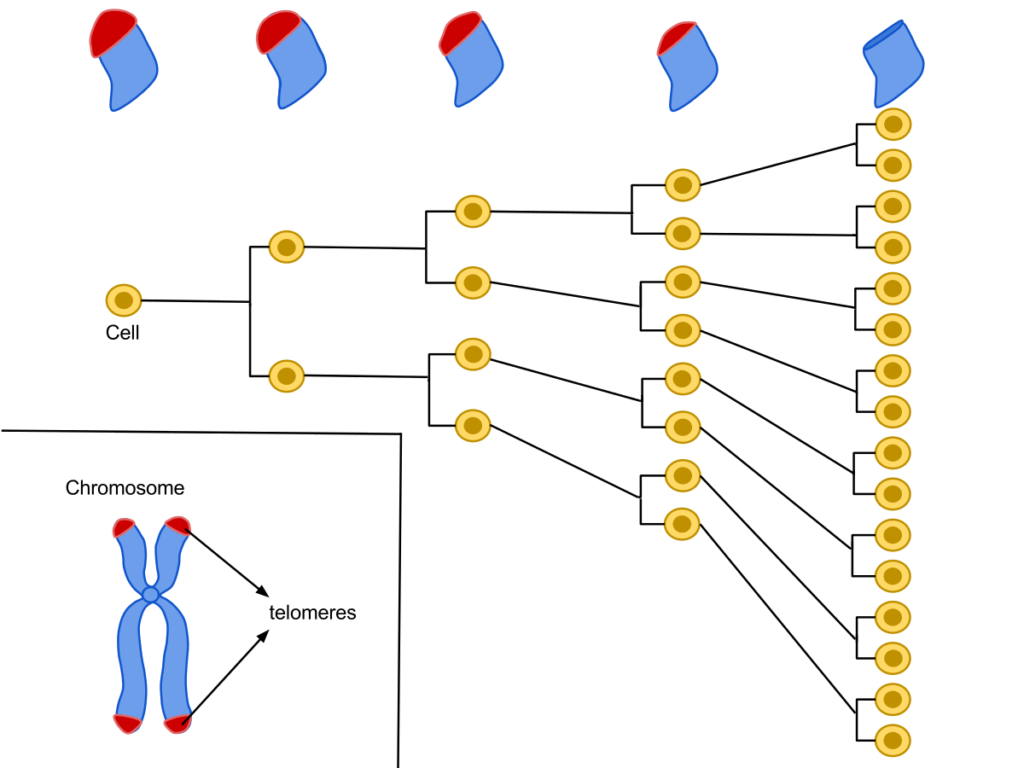
У ДНК-полимеразы существует одна особенность: она не способна синтезировать нить ДНК с самого конца. Это своего рода «не баг, а фича»: благодаря такой особенности фермента нити ДНК при каждом делении укорачиваются на определенную длину. Казалось бы, получающиеся при таком процессе клетки будут неполноценными с генетической точки зрения, ведь может теряться важная информация. Но, благодаря существованию теломер, этой потери до определенного момента не происходит: концевые последовательности ДНК смиренно уменьшаются в размерах, позволяя сохраниться генетическим данным, которые они обрамляют.
Наилучшим кратким определением для теломер будет «обратный счетчик количества клеточных делений». Каждая клетка может пройти примерно через 50 делений: после этого теломеразная защита исчерпается, и это служит сигналом для начала апоптоза – запрограммированной клеточной смерти. Число в 50 делений называют «пределом Хейфлика» – в честь Леонарда Хейфлика, который этот лимит делений и открыл. Хейфлик со своим коллегой Полом Мурхедом поставил простой и наглядный эксперимент. Ученые в равных частях смешали фибробласты, взятые от мужчин и от женщин; при этом мужские клетки уже прошли 40 циклов делений, а женские – только десять. Роль контрольной группы играли чисто мужские фибробласты.

Когда клетки в контрольной культуре перестали делиться, Хейфлик с Мурхедом обнаружили, что смешанная культура уже не смешанная: все мужские фибробласты в ней погибли, остались лишь женские клетки. На основании этого Хейфлик и сделал свой вывод о жизненном лимите клеток человеческого организма.
Открытие теломеразы
Однако не всегда и не везде жизненный цикл клетки предопределен теломерами. Существует механизм, который позволяет сделать клетку фактически бессмертной, а имя ему – теломераза.
Существование теломеразы было предсказано еще в 1974 году как способ объяснить отсутствие старения у некоторых типов клеток – причем клеток как здоровых (стволовых), так и патологически измененных (например, клеток раковых опухолей). Предсказал существование этого фермента 45-летний советский ученый Михаил Оловников, назвав его тандем-ДНК-полимеразой. А уже через семь лет, в 1981 году, американка Элизабет Блекберн подтвердила теорию Оловникова, выделив этот фермент.

Вместе со своей аспиранткой Кэрол Грейдер Блэкберн выделила и очистила фермент, показав, что, кроме белков, в его состав входит еще РНК. К середине 1980-х ряд экспериментов показал, что у организмов с мутацией в теломеразных РНК происходит ускоренное укорачивание теломер, а клетки этих организмов развиваются очень медленно и в конце концов прекращают рост. Элизабет Блэкберн подтвердила этот феномен у тетрахимен (пресноводных инфузорий), Кэрол Грейдер – на клетках человека, а еще один американский ученый Джек Шостак – в культуре дрожжей. Этих троих ученых объединяет еще один факт: в 2009 году «за открытие того, как теломеры и фермент теломераза защищают хромосомы» они были удостоены Нобелевской премии.

Эти открытия перевернули взгляд на генетику старения. Многие ученые наперебой заявляли, что теломераза – ключ к вечной молодости, причем не просто отдельной клетки, а организма в целом. Однако дальнейшие события показали, что не все так просто – и один-единственный ключ всех дверей не откроет. Впрочем, об этом позже.
Болезни, связанные с теломерами и теломеразой
Дисфункция теломеразы и теломер приводит ко множеству патологических состояний и заболеваний. Большинство из них были описаны задолго до открытия «фермента бессмертия», в первой половине XX века. Например, при врожденном дискератозе из-за генных мутаций и связанных с ними дефектов TERT и TERC теломеры больных очень короткие. Это приводит к тому, что у большинства клеток нарушается нормальный цикл деления и возрастает нестабильность генома. А те немногие клетки, которые способны поддерживать активность фермента, довольно быстро превращаются в раковые. В результате три четверти больных дискератозом не доживают даже до 30 лет.
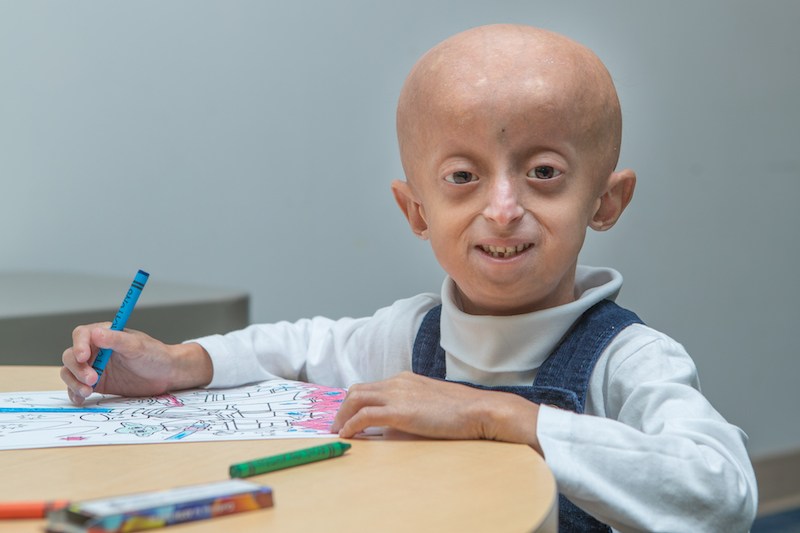
Пожалуй, самое известное заболевание, связанное с дефектами теломер, – детская прогерия, или же синдром Хатчинсона – Гилфорда. При этом заболевании происходит мутация гена LMNA, отвечающего за синтез ламина – белка, который входит в состав оболочки клеточного ядра. Дефектная форма ламина, так называемый прогерин, нарушает многие генетические процессы, в том числе сильно укорачивает теломеры. Детская прогерия наглядно показывает, как нарушение механизмов клеточного старения отображается на организме в целом. Больные уже в возрасте четырех-пяти лет выглядят как старички: птичье лицо, заостренный нос, дистрофические процессы в ногтях, волосах и зубах. Такие дети редко доживают хотя бы до совершеннолетия.
Некоторые болезни влекут за собой дисфункцию теломер, что лишь еще сильнее подкашивает и без того слабый организм. Такова хорея Хантингтона – аутосомно-доминантное генетическое заболевание. Его причина кроется не в теломерах, а в гене, кодирующем белок хантингтин с неизвестной пока ученым функцией. Однако, помимо всего прочего, развитие хореи Хантингтона влечет за собой и сокращение длины теломер. Исследование, проведенное мексиканскими учеными, показало, что у больных с проявляющимися симптомами теломеры оказались примерно в полтора раза короче, чем у здоровых людей или у больных на ранней стадии.
Скорее всего, из-за накопления хантингтина в митохондриях там образуется больше активных форм кислорода, что приводит к развитию окислительного стресса и повреждению теломер. При этом мутантный белок блокирует ферменты, которые отвечают за репарацию ДНК, поэтому дефектные теломеры остаются укороченными.
Ну и, конечно, рассказывая о теломерах, нельзя обойти стороной онкологические заболевания. Причем в этом случае проблема уже не в слишком коротких, а чрезмерно длинных теломерах. Важный факт: чаще всего опухолевые структуры возникают именно в постоянно обновляющихся тканях, где теломеразная активность высока и в нормальном состоянии.
Этот факт наводит на мысль о том, что нормальное состояние нашего организма и то, как он стареет, – природная «золотая середина», способ соблюсти равновесие между слишком быстрым старением и превращением в массу постоянно пролиферирующих клеток. Изучение теломеразы в контексте рака неизбежно приводит к выводу о том, что большая длина теломер как таковая не ведет ни к вечной, ни хотя бы к продленной молодости.
Отличное подтверждение тому – мыши. В норме длина теломер у этих грызунов заметно длиннее, чем у людей: иногда в четыре-пять раз. У некоторых линий лабораторных мышей длина теломерных последовательностей вовсе может достигать 150 тысяч пар нуклеотидных оснований (у человека эта цифра обычно не превышает 15 тысяч пар). Во многом поэтому лабораторные мыши – популярный модельный объект для изучения механизмов формирования и лечения опухолей.
Механика «бессмертных кусочков»
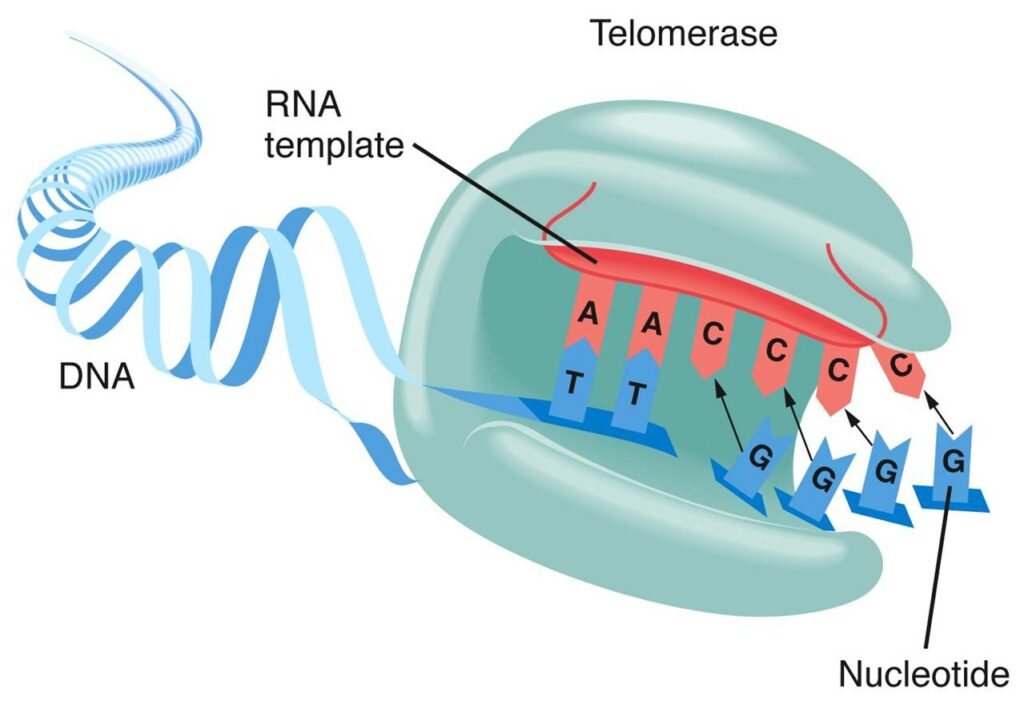
Теломераза – не одна молекула, а сложный рибонуклеопротеиновый комплекс. Выражаясь более простым языком, совокупность белков и РНК. Главные компоненты этой совокупности – теломеразный РНК-компонент TERC и теломеразная обратная транскриптаза TERT. TERC – это последовательность нуклеотидов, содержащая специальный участок (ААУЦЦЦ), матрицу, на которой TERT синтезирует комплементарную нить ДНК. Присоединяясь к так называемому 3’-концу ДНК (со свободной гидроксильной группой), теломераза добавляет к нему последовательно по одному нуклеотиду.
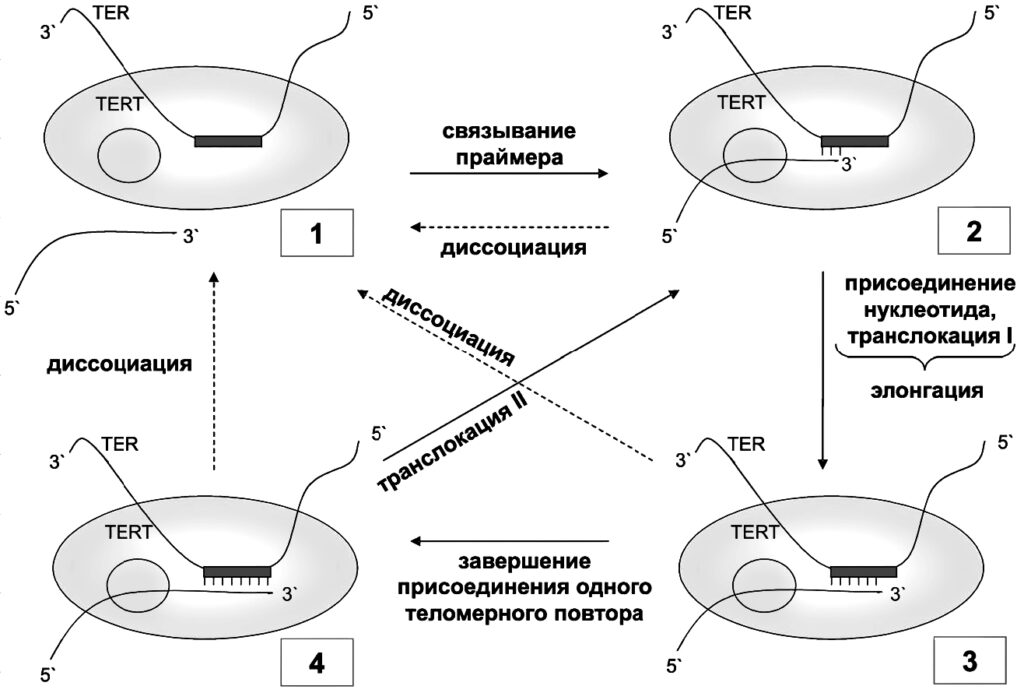
Этот матричный участок фланкируют (обрамляют) два элемента: 5’-матричный ограничивающий и 3’-матричный узнающий. 5’-элемент представляет собой двухцепочечный участок, расположенный непосредственно перед РНК-матрицей: он регулирует добавление нуклеотидов в ходе обратной транскрипции и, по-видимому, служит участком связывания с TERT. С помощью мутагенеза было показано, что для эффективного функционирования теломеразы важна не сама по себе нуклеотидная последовательность, а именно вторичная структура этого участка.
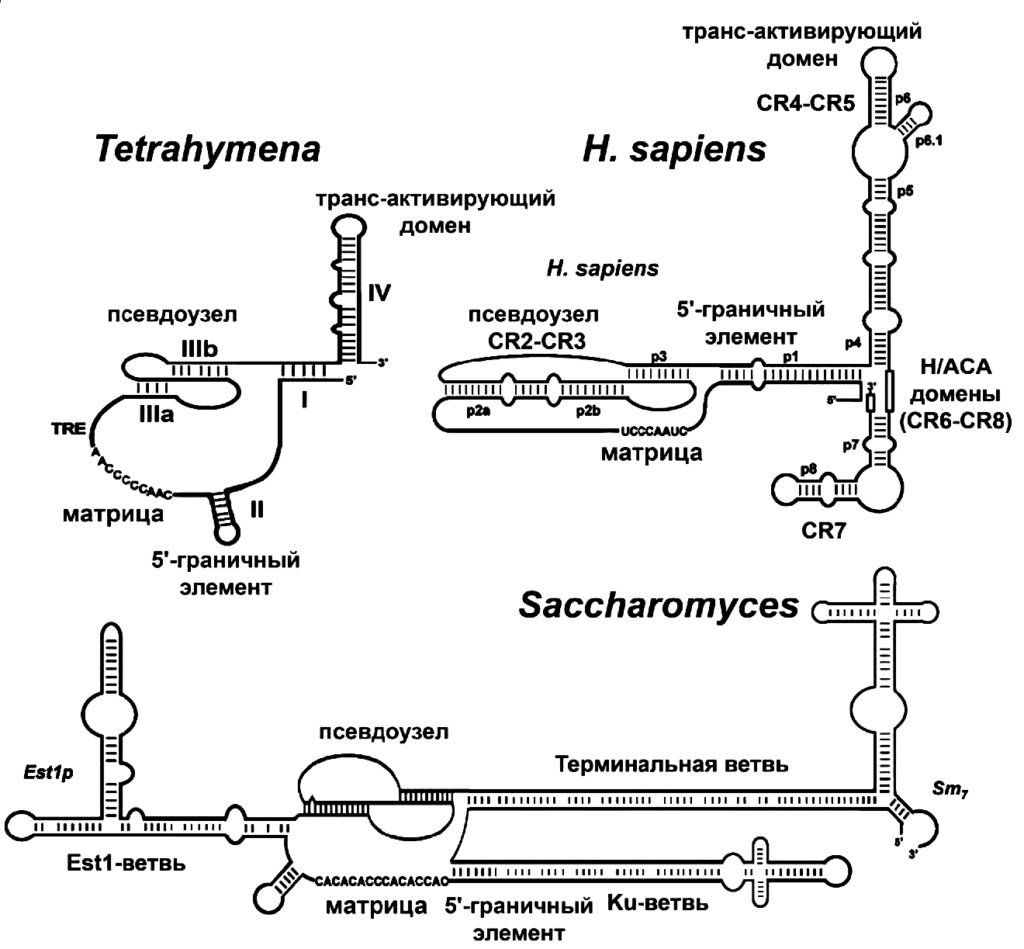
млекопитающих, а также человека и дрожжей Saccharomyces / ©thepresentation.ru
3’-узнающий элемент – одноцепочечная структура, расположенная после матричного участка, которая позволяет концу матрицы занять место в активном центре теломеразы, стимулирует теломеразную активность, а также содержит участок связывания N-конца TERT-субъединицы.
Из элементов вторичной структуры теломеразной РНК наиболее интенсивно изучается псевдоузел, или же стабилизирующая шпилька. Изменения стабильности псевдоузла приводят к снижению активности теломеразы, что указывает на важную биологическую роль этого структурного элемента. Полученные за последнее время результаты изучения олигонуклеотидов, имитирующих элементы структуры псевдоузла TERС, подтвердили, что именно динамика третичной структуры псевдоузла играет важную роль в функционировании теломеразы.
Как мы уже писали выше, бессмертие всем клеткам организма не требуется. Соответственно, и теломераза не везде активна. TERC-компонент транскрибируется во многих клетках, но обратная транскриптаза в большинстве из них отсутствует. Полностью функциональный теломеразный комплекс можно найти в половых и стволовых клетках. Также активность теломеразы наблюдается в клетках, которые постоянно делятся (например, клетки кишечного эпителия и B-лимфоциты).
Как жить дольше и при чем тут «мышь Мафусаила»?
Неудивительно, что практически сразу после открытия теломеразу назвали ферментом бессмертия и начали искать способы с ее помощью если не повернуть старение вспять, то хотя бы максимально его замедлить. Когда теломеры в клетке укорачиваются до определенной критически малой длины, запускаются механизмы клеточного сенесенса и апоптоза – гибели клетки.
Логично, что многие ученые ухватились за мысль о том, что влияние на функцию теломер каким-то образом способно помочь продлить человеческую молодость. Как раз в 1980-е, когда существование теломеразы и ее роль в старении клеток были подтверждены, начали развиваться методы генной терапии. Были выделены отдельные гены, начали активно создаваться экспрессирующие векторы (генетические конструкции для переноса информации в клетку и ее последующего использования), а переносы генов у мышей и других лабораторных животных стали обычным делом.
Применение методов генной терапии, направленных на теломеры, было вопросом времени. Впрочем, подобный подход вызывал множество опасений. ДНК – структура сложная, клетка в целом – еще сложнее. Риск того, что «пранк выйдет из-под контроля» очень высок. Почему бы не обратиться к проверенному методу – приему фармацевтических препаратов? Или обратиться к таким методам, как ограничение питания?
Да, подобными относительно тривиальными методами можно добиться серьезных результатов. Так, в 2004 году Стивен Спиндлер из Университета Риверсайда в Калифорнии смог при помощи ограничения калорийности питания группы мышей добиться того, что средняя продолжительность жизни грызунов составила 1356 дней, или же около 3,5 лет. И это действительно много – с учетом того, что обычно эти животные в среднем живут порядка двух лет.
Стоит заметить, что Спиндлер работал с мышами далеко не с момента их рождения. Ученый взял 19-месячных животных (среднего возраста по человеческим меркам): применительно к людям это все равно что взять человека в возрасте слегка за 40 и обеспечить ему доживание до 90 лет.
Однако методы генетического редактирования, конечно, гораздо перспективнее по многим причинам. Во-первых, результаты, которых с их помощью можно добиться, более впечатляющие. Так, Анджей Бартке при помощи методов генетической модификации смог создать мышь, которая прожила 1819 дней – более пяти лет. За свою разработку Бартке и его подопытная получили специальный «приз мыши Мафусаила», названный так в честь библейского долгожителя.

Во-вторых, ограничение питания или прием медикаментов – работа на всю жизнь. А с редактированием генетической информации все просто: один раз поправил, что нужно, и живешь себе дальше. Ну и самое главное: у генной терапии более высокая степень направленности, чем у лекарств, которые проявляют большое количество побочных эффектов.
Нестрашный вирус продлевает жизнь грызунам
Но насколько бы ни был перспективнее подход прямого воздействия на гены, не стоит забывать о необходимости поиска золотой середины. Да, короткие теломеры и неактивная теломераза ведут к быстрому старению, но слишком активная теломераза – это высокие шансы заполучить раковую опухоль. Поэтому задача, стоящая перед учеными, которые занимаются вопросами омоложения и геронтологии, сформулирована так: как активировать работу теломеразного комплекса на ограниченном временном промежутке?
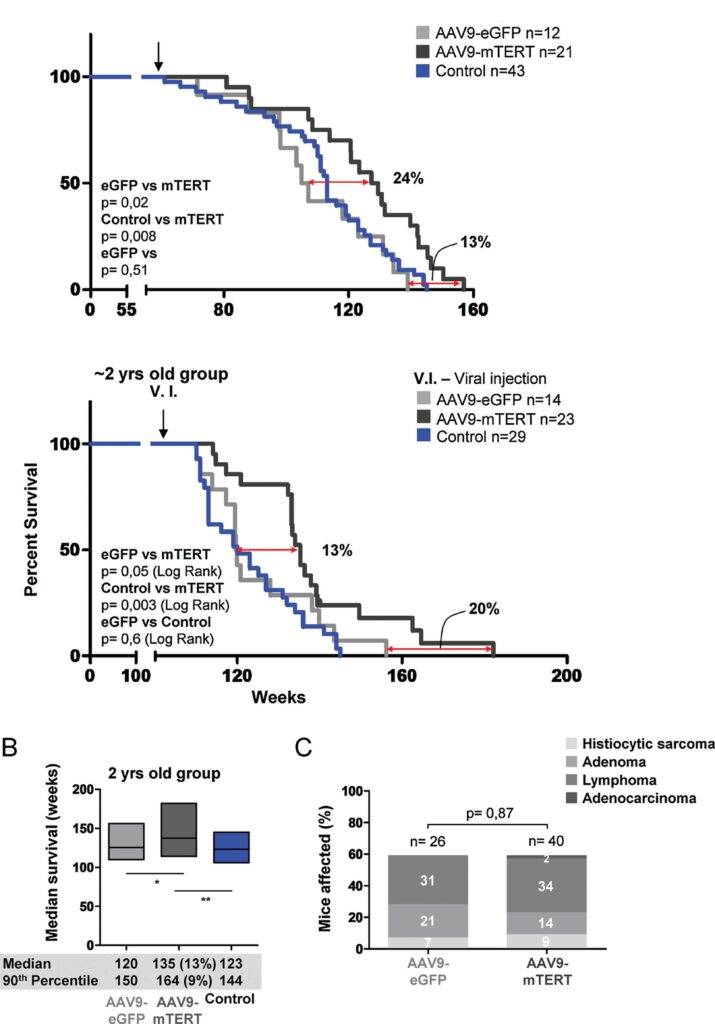
Определенных успехов в этом добилась группа ученых из Испанского национального центра изучения рака под руководством Марии Бласко. Взяв две группы мышей (одно- и двухлетнего возраста соответственно), исследователи вводили им при помощи инъекций ген обратной теломеразной транскриптазы TERT. В качестве векторной основы для попадания этого гена в геном модифицируемого организма был выбран аденоассоциированный вирус (AAV).
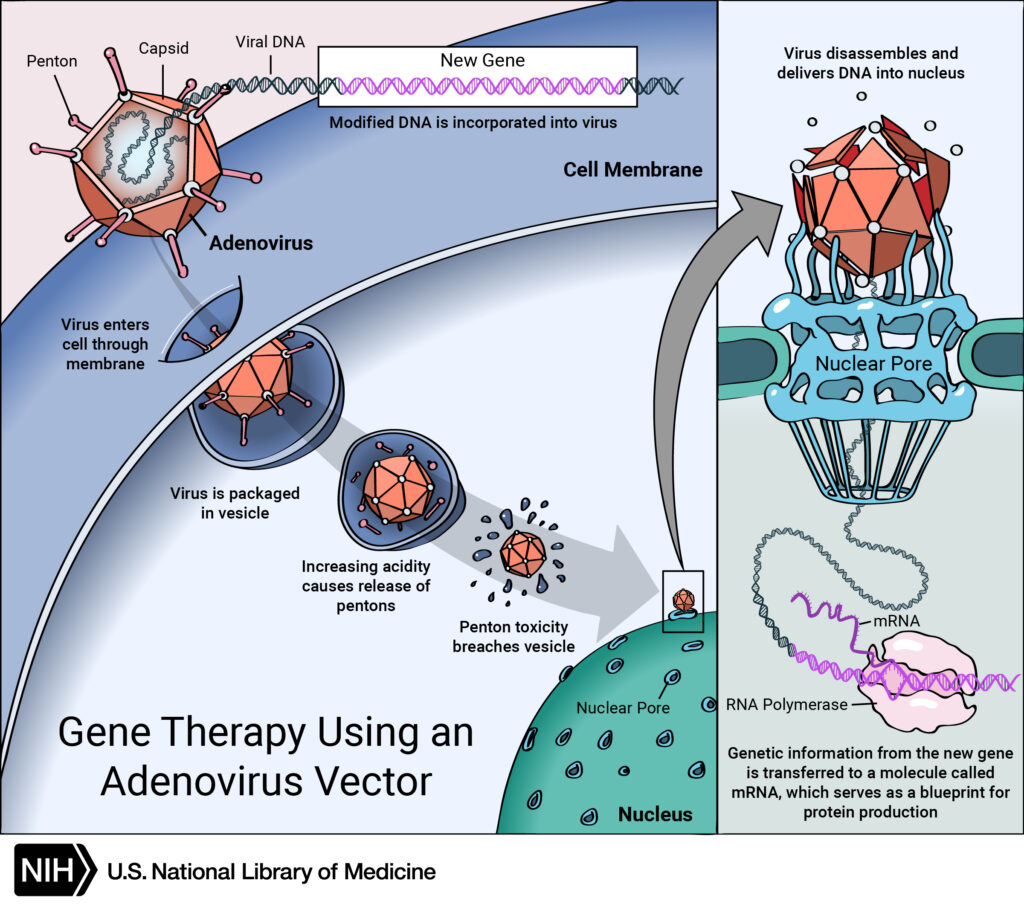
Звучит жутковато, но не стоит пугаться: AAV нельзя назвать патогеном, он не вызывает никаких симптомов болезни и провоцирует очень слабый иммунный ответ. К тому же хотя этот вирус и внедряет свои гены в геном хозяина, но весьма предсказуемо, по специфическому сайту, а встраивание в случайные сайты происходит исчезающе редко.
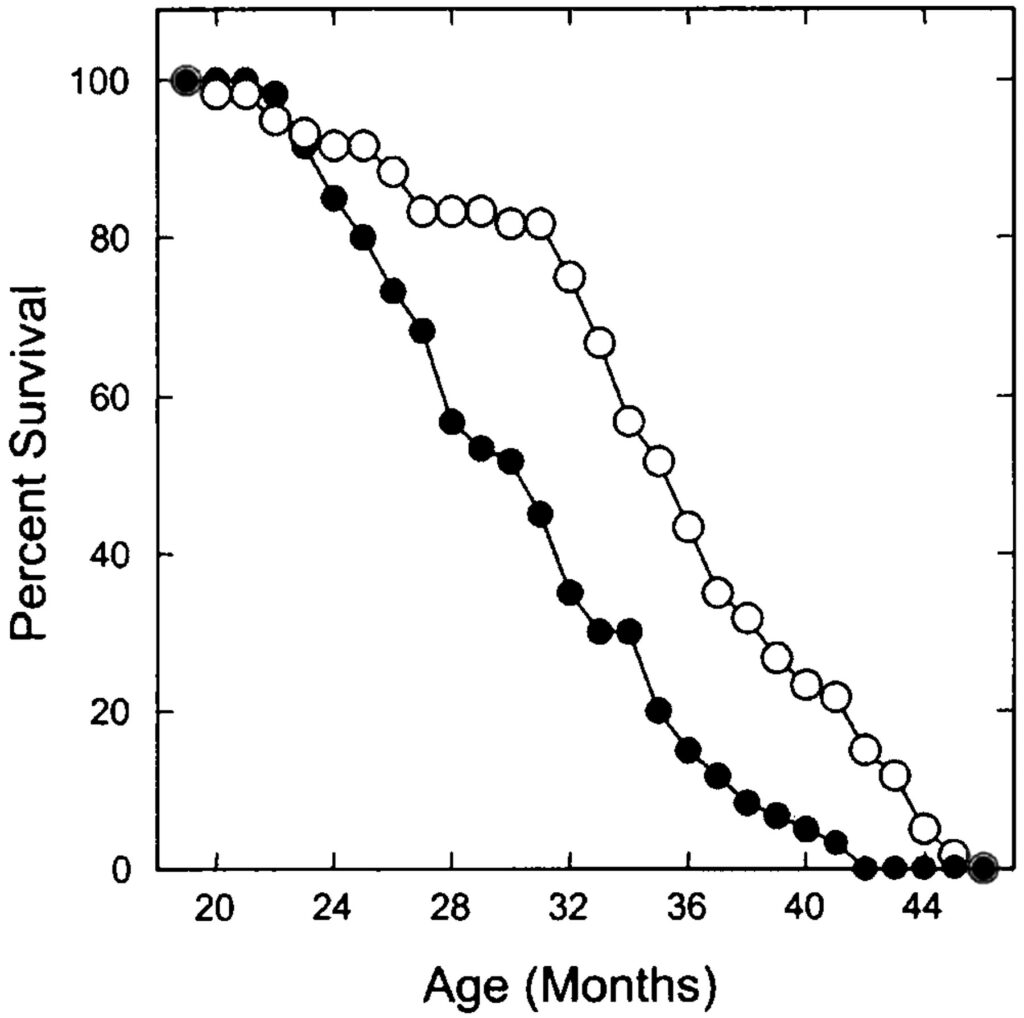
Такая терапия, как видно на изображении выше, увеличила продолжительность жизни грызунов на 24% для однолетних мышей и на 13% – для двухлетних. Это не настолько впечатляюще, как результаты, полученные Бартке и Спиндлером, но вполне значимо. Также важно, что в опытах Бласко у мышей, которые получили инъекцию AAV, не наблюдалось повышения онкогенной активности теломеразы по сравнению с контрольной группой животных.
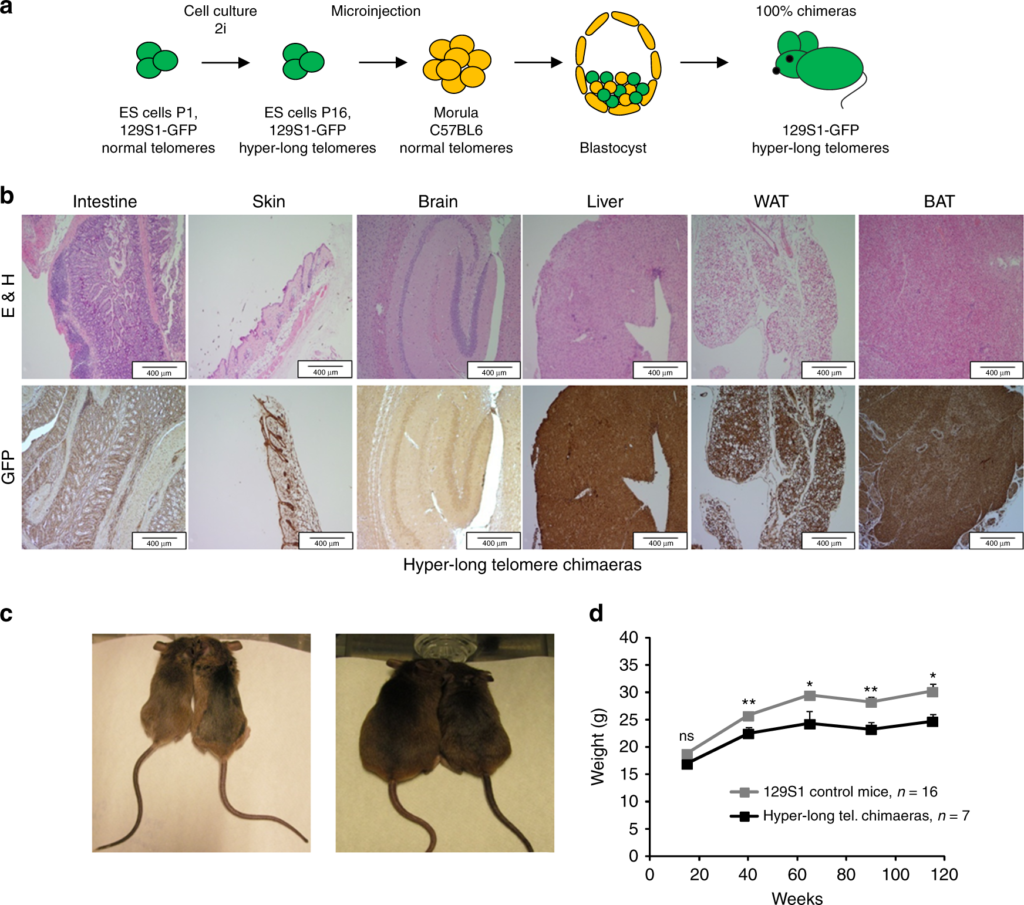
Еще в одном интересном эксперименте ученым удалось «усовершенствовать» теломеры, не повышая при этом онкогенную активность в организме мышей. Испанские исследователи создали грызунов с удлинненными теломерами, воспользовавшись оригинальной методикой. Авторы обратили внимание на то, что наиболее высокая активность теломеразы наблюдается в стволовых клетках в первые дни существования зародыша, а затем постепенно снижается. Отбирая из зародышей стволовые клетки для выращивания в культуре и не давая им дифференцироваться, биологи добились того, что теломераза обеспечила этим клеткам теломеры вдвое длиннее, чем у обычных здоровых мышей.
Затем такие «суперклетки» вводили в зародыши обычных мышей. В результате ученые получили химерных грызунов: в их плаценте и зародышевых оболочках были клетки с короткими теломерами, а весь остальной организм мыши состоял из клеток с удлиненными за счет хвостовых последовательностей хромосомами. Последующие наблюдения показали, что у мышей-химер длина теломер в любом возрасте была хотя бы на четверть длиннее, чем у немодифицированных «ровесников». Притом теломераза в соматических клетках оставалась неактивной.
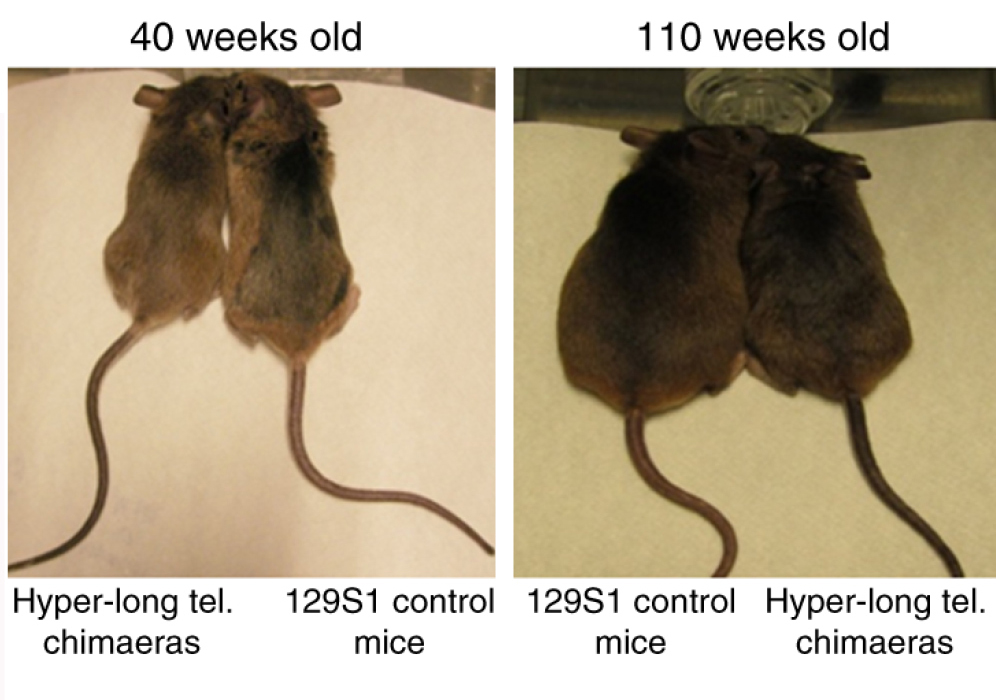
Такие мыши-химеры были заметно стройнее своих обычных сородичей, в их крови было в несколько раз меньше так называемого плохого холестерина (липопротеинов низкой плотности). А еще модифицированные мыши жили дольше: их средняя продолжительность жизни увеличилась на 13% по сравнению с контрольной группой животных, а максимальная продолжительность – на 8%. К тому же они и раком болели реже, чем мыши из контроля!
Важный биохимический маркер – соматомедин
Конечно, теломераза – вовсе не единственная мишень генетической терапии, способная повлиять на процессы старения. Например, гормон роста, также известный как соматотропин. К подобной идее ученые пришли после того, как оказалось, что есть определенный уровень этого гормона в организме, который соответствует максимальной продолжительности жизни. Если уровень выше или ниже, то риск смерти от всех причин повышается.
Многочисленные эксперименты показали, что удобнее воздействовать не на сам соматотропин, а на один из его посредников – инсулиноподобный фактор роста-1, или же соматомедин. Это вещество секретируется в печени в ответ на стимуляцию соматотропиновых рецепторов этого органа и регулирует секрецию соматотропина и соматостатина.
Как показали опыты ученых из Гетеборгского университета, проведенные в 2012 году, оптимальный уровень соматомедина, обеспечивающий минимальный риск смертности от всех причин, колеблется в диапазоне 105-125 мг/мл. Практически к аналогичным выводам пришли исследователи из США двумя годами позже. Их работа показала, что у людей в возрасте от 50 до 65 лет именно при таком уровне ИФР-1 был отмечен наименьший риск смерти от всех причин.
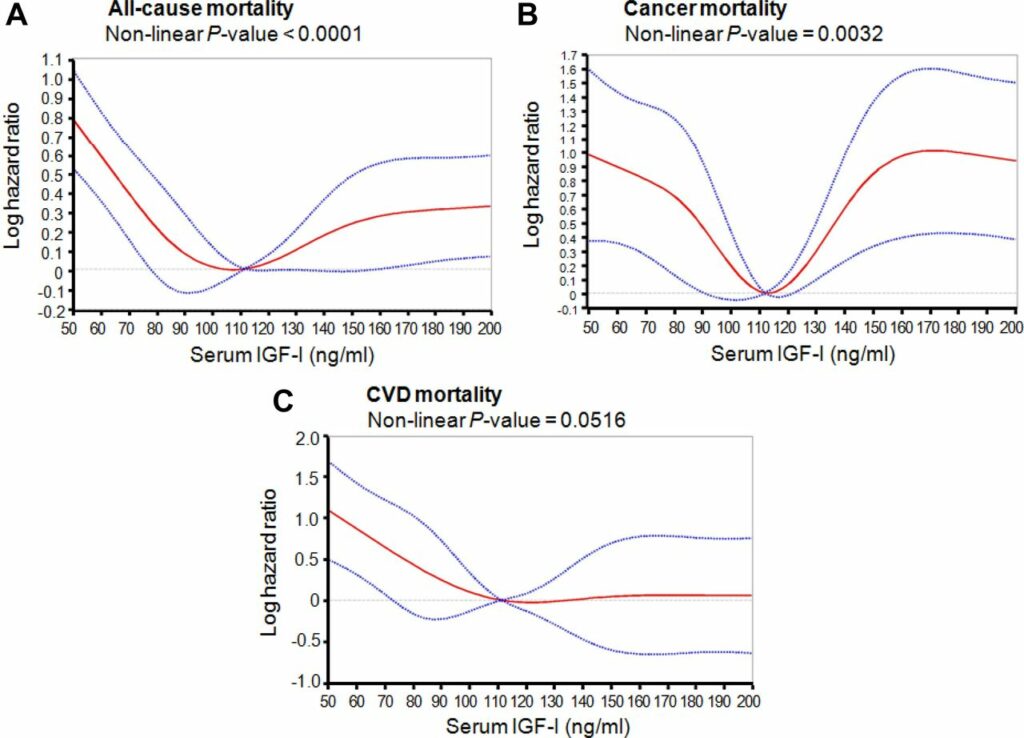
Но повлиять напрямую на уровень медиатора в крови сложно, поэтому в качестве итоговой мишени выбрали ген рецепторов гормонов роста. Технология GHRKO (частичный нокаут генов гормона роста) была опробована на мышах в 2016-2017 годах; эксперименты показали, что продолжительность GHRKO-мышей примерно на треть выше, чем у мышей дикого типа. Кстати, примерно такие же результаты показали грызуны, которых специально держали на диете для снижения уровня соматомедина.
Еще один важный биохимический компонент, способный увеличить продолжительность жизни, – фактор роста фибробластов FGF-21. Эта молекула усиливает поглощение глюкозы адипоцитами, клетками жировой ткани. FGF-21 синтезируется в ответ на недостаток питательных веществ, чтобы помочь приспособиться к голоданию. Среди прочего FGF-21 блокирует гормоны роста, снижая концентрацию соматомедина.
Ну а что там у людей?
Впрочем, выше мы все время пишем о мышах да о мышах – а как же с увеличением срока жизни и отсрочкой старения у людей? Неужели не слышно ни о каких результатах? Тем более что бюджеты ведущих мировых организаций, изучающих борьбу со старением, исчисляются десятками миллионов долларов в год.
Почему-то методики, которые дают хорошие результаты у мышей (а также у других короткоживущих существ – вроде червей или мух), на приматах уже не работают. В частности, стоит упомянуть два довольно крупных исследования, которые стартовали в США в конце 1980-х. В них ученые исследовали влияние 30-процентного ограничения калорий в рационе на продолжительность жизни макак-резусов.
В 2017 году по этим двум исследованиям была опубликована обзорная статья в Nature под названием Caloric restriction improves health and survival of rhesus monkeys («Ограничение калорий улучшило здоровье и выживаемость макак-резусов»). Но не ищите там ничего обнадеживающего и сверхъестественного: улучшение ограничивается пятью процентами.
А что насчет теломеразы? Пожалуй, самый известный эксперимент на эту тему – опыт, который американка Элизабет Пэрриш поставила… сама на себе. В 2015 году Пэрриш ввела себе два вектора на основе AAV: первый содержал ген теломеразы TERT, а второй – ген фоллистатина, стимулятора мышечного роста и антагониста миостатина (до этого фоллистатин успешно испытывали на людях с мышечной дистрофией). На подобное Пэрриш вдохновили результаты, полученные ранее группой Бласко на мышах.

Уже через год эксперимента были опубликованы первые результаты. Тогда многие мировые СМИ пестрили заголовками в стиле «женщина омолодила себя на 20 лет». Почему именно 20? Исследование хромосом Пэрриш показало, что теломеры в ее лимфоцитах удлинились в среднем с 6710 пар оснований до 7330 пар. Если учесть, что в клетках иммунной системы скорость укорочения теломерных последовательностей составляет около 30 пар в год, то как раз и получаем те самые условные 20 лет – хотя экстраполировать это на весь организм в целом, конечно, не стоит.
В процентном соотношении теломеры удлинились всего лишь на 9%. Здесь стоит сказать, что при измерении длины хромосомных последовательностей методом количественного ПЦР погрешность в норме может достигать 8–10%. Этот факт сразу вызвал определенный скепсис по отношению к Пэрриш и ее эксперименту. Однако исследовательница заявила, что результаты измерений были подтверждены в двух независимых лабораториях.
Годом позже Пэрриш выпустила пресс-релиз с результатами генной терапии. В нем, в частности, она опубликовала МРТ своих бедер. Якобы сравнение снимков, сделанных в 2015 и 2017 годах соответственно, демонстрировало снижение так называемой мраморности мышц, то есть уменьшение количества жировых отложений внутри мышц. Это в принципе могло быть позитивным эффектом от терапии фоллистатином. Однако и здесь у многих экспертов возникли серьезные сомнения в данных.
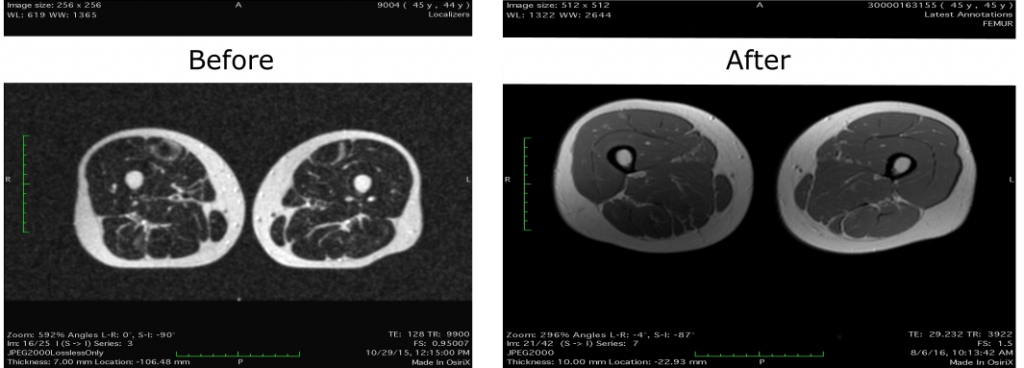
Во-первых, между снимками прошло два года, и не исключено, что разница на изображениях обусловлена лишь тем, что в арсенале исследовательницы появился аппарат получше. Во-вторых, хорошо заметна разница в расстоянии между двумя ногами на срезах. Конечно, женщина просто могла поставить ноги немного шире, тем более что попробуй вспомни, как в прошлый раз проходила процедура.
Хейфлик, Шостак и Оловников не в восторге
По сути, эксперимент Пэрриш нельзя таковым называть: подтверждением каких-либо положительных результатов служат только субъективные ощущения одного человека и измерения, которые даже экспериментальными не назовешь. Никаких стандартов такой подход, конечно, не выдерживает. Однако и тема специфическая, поэтому просто не заметить этот случай тоже невозможно.
Что о Пэрриш думают патриархи генетики? Один из «отцов» теломеразы Джек Шостак, получивший Нобелевскую премию за работы по объяснению механизмов защиты хромосом, вообще назвал подход Пэрриш ненаучным, а ее саму сравнил с мошенницей, которая хочет одурачить людей и выманить у них деньги на непроверенный, а возможно, и опасный препарат.
Леонард Хейфлик, с открытия которого началось изучение клеточного старения и теломер, тоже не был в восторге. Первооткрыватель предела клеточных делений не был резок в высказываниях, но никаких особых надежд насчет опыта по омоложению не питает. «С древнейших времен люди экспериментируют, пытаясь отсрочить старость. Но по разным причинам успеха пока никто не достиг, – грустно резюмирует Хейфлик. – Более того, у нас нет средства для определения эффекта. Люди веками считают, что их знаний по биологии достаточно, чтобы понять, как победить старение. Но поскольку этот процесс – результат второго закона термодинамики, вероятность успешного вмешательства близка к нулю. Все во Вселенной стареет».
А вот Алексей Оловников – человек, который выдвинул саму идею существования теломеразы – об американке отозвался замысловато. В интервью изданию «Кот Шредингера» ученый заявил, что восхищен мужеством Элизабет, и отметил две составляющих ее поступка: «смелость и желание пропиарить свою компанию». Тут сразу и не поймешь, где ирония, а где – действительно восхищение.
Обещания Уильяма Эндрюса
До сегодняшнего дня Элизабет Пэрриш остается единственным клиентом стартапа BioViva, который воспользовался их продукцией. Никаких известий о клинических испытаниях продукта (успешных или неуспешных), никакой информации о новых клиентах в Сети не появилось. Женщина, решившая омолаживать сама себя, пока остается единственной в своем роде.
Тем не менее у BioViva уже появился первый реальный конкурент – компания Libella Gene Therapeutics. Ее представители также собираются вводить пациентам вирусные векторы с геном теломеразы. Кроме того, первые клиенты фирмы должны фактически стать участниками первого клинического испытания продукции. Кстати, о клиентах: осенью 2019 года представитель компании заявлял, что у них уже есть два потенциальных покупателя, которые должны были получить свои инъекции в начале нынешнего года. Меж тем, для того, чтобы воспользоваться продукцией Libella Gene Therapeutics, нужно быть очень и очень богатым человеком или найти серьезного спонсора: такая терапия стоит миллион долларов. Однако представитель фирмы Джефф Матис утверждал, что 79-летний мужчина и 90-летняя женщина за это лечение уже заплатили. Впрочем, с декабря прошлого года никаких новостей от компании не слышно; правда, ее веб-сайт все еще работает, да и за свой миллион с ними пока никто не судится. Возможно, все договоренности в силе, и как только в мире схлынет коронавирусная волна, эксперименты возобновятся.
Однако в этом есть определенные сомнения, и главная их причина – основатель компании и ее ведущий научный сотрудник Уильям Эндрюс. На счету этого респектабельного мужчины в очках и с галстуком уже несколько невыполненных громких обещаний. Так, еще в 2017 году Эндрюс обещал развернуть испытания теломеразы для технологий омоложения (чего, как мы уже знаем, не случилось). А годом ранее Уильям, будучи сотрудником другой компании, рассказывал о планах по строительству на Фиджи клиники для услуг по омоложению. Кстати, той самой компанией, где Эндрюс тогда подвизался, была BioViva.

Причина номер два – стоимость такой терапии. Раз уж потенциальные участники клинических заболеваний именуются клиентами и обязаны самостоятельно оплачивать процедуры, очевидно, спонсоров, которые хотели бы вложиться в разработки компании, не нашлось. Оно и понятно: никаких толковых результатов что на обезьянах, что на людях, пока не получено, и вообще неизвестно, есть ли смысл дальше корпеть над векторами с геном TERT. При этом выложить миллион долларов вряд ли смогут много людей, а, соответственно, их число в любом случае не будет достаточным для того, чтобы сделать какие-то конкретные и статистически значимые выводы. Наглядные снимки МРТ бедер – оригинально, но, увы, эффективности терапии не подтверждает.
Биопираты и научные Робин Гуды
Если стоимость – одно из главных препятствий для препарата, то можно ли сделать его дешевле? И речь здесь не только об эффективности, но и о возможности провести достаточно массовые испытания. Если они и покажут полную бесполезность созданного лекарства, то в процессе могут заодно указать путь, по которому нужно двигаться.
Над такой проблемой работают биохакеры под руководством Габриэля Лисины. Правда, их интерес направлен не на средства для омоложения, а генетическую терапию как таковую. В частности, в прошлом году Лисина и его коллеги создали «пиратскую версию» препарата для коррекции дефицита протеинлипазы. Это очень редкое генетическое нарушение, при котором организм не способен расщеплять сложные жиры, в результате чего они накапливаются в крови, в органах и под кожей. Справляться с дефицитом протеинлипазы можно при помощи жесткой диеты с целым рядом дополнительных ограничений – или «подкрутить настройки генома».
Обычно (насколько это применимо к редкому заболеванию) дефицит протеинлипазы лечат при помощи Glybera – первого в истории метода генной терапии, который одобрен для использования в клиниках ЕС и Соединенных Штатов. При этом стоимость инъекции Glybera такая же, как у препарата, предлагаемого Libella Gene Therapeutics: один миллион долларов. Команда Лисины создала аналог препарата под названием Slybera (здесь скрыта тонкая игра слов: sly в переводе с английского значит «хитрый»). А стоимость этого аналога – всего лишь семь тысяч. Разница – почти в 143 раза!

Теоретически подход, использованный Лисиной при создании Slybera, можно применить и к препарату теломеразы. Slybera создан по схеме, уже описанной нами ранее: на основе вирусного вектора. Последовательность гена – будь то ген протеинлипазы или ген теломеразы – можно найти в открытых базах данных. Биохакеры взяли последовательность здорового гена из открытых статей, которые выходили во время разработки Glybera, и отправили ее в коммерческую лабораторию, синтезирующую ДНК на заказ. В итоге получилась кольцевая молекула ДНК с нужным геном, которую авторы проекта и предлагают использовать как альтернативное лекарство.
О преимуществе такого подхода мы уже сказали: стоимость пиратской версии препарата отличается от официального продукта на много порядков. Однако недостатки все же могут оказаться значимее. Просто молекула ДНК будет гораздо хуже проникать в клетки, а гены, которые она содержит, будут менее активно экспрессироваться. Помимо прочего, более дешевый препарат по факту не такой уж дешевый: взять да выложить просто так семь тысяч из своего кармана могут не так много людей, нуждающихся в генной терапии.
Важна не длина, а скорость: работает и для теломер
В последнее время появляется все больше работ, которые свидетельствуют о том, что длина теломер сама по себе не коррелирует с продолжительностью жизни. Одна из таких была опубликована в августе прошлого года в журнале Aging Cell. Ученые проанализировали длину теломерных последовательностей у 379 758 человек, чью биологическую информацию взяли из исследовательской базы данных UK Biobank. При этом около 261 тысячи испытуемых на момент окончания исследования были старше 60 лет.
На протяжении 7,5 года исследователи проверяли связи между генетически определенной длиной теломер и связанными со старением исходами для здоровья. В ходе работы выделили 13 генетических вариантов, связанных с большей длиной теломер в периферических лейкоцитах. Было установлено, что более длинные теломерные последовательности значимо связаны с меньшим риском ишемической болезни сердца. А вот риск развития раковых опухолей при этом заметно возрастал – что, впрочем, неудивительно.
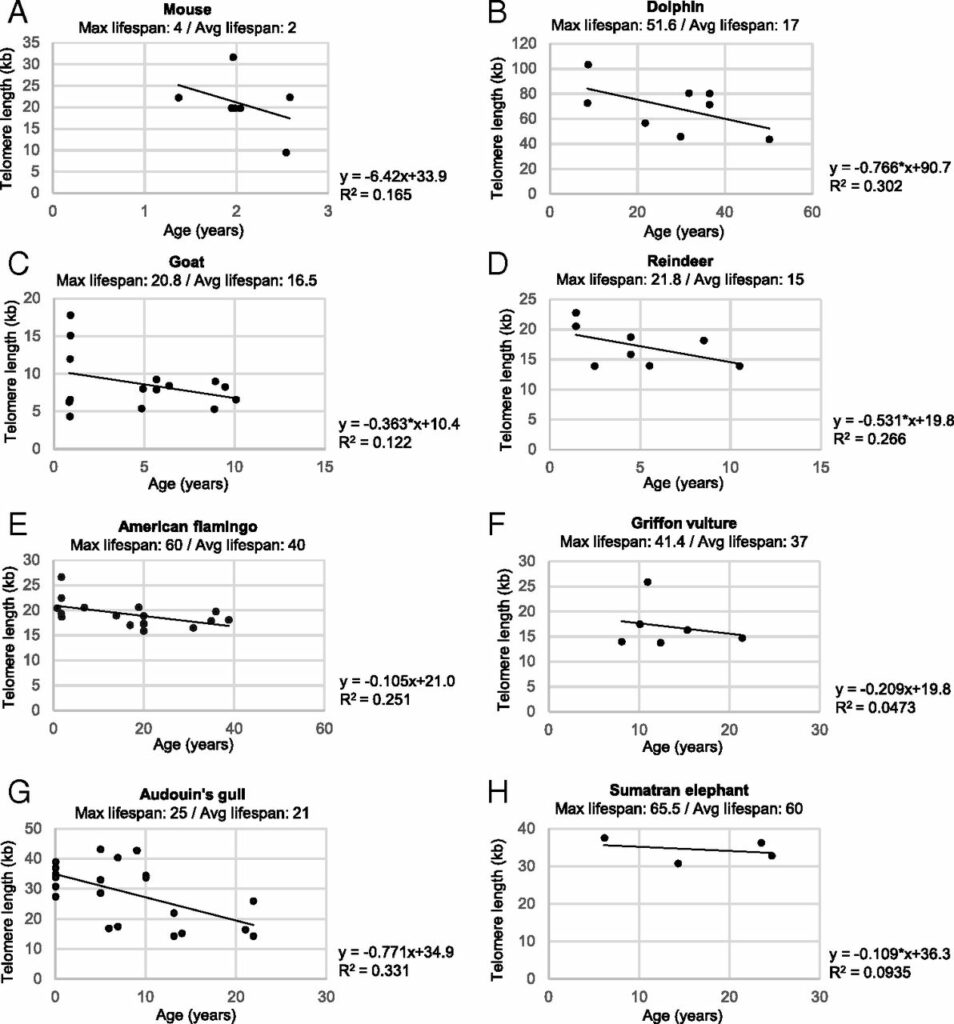
Самое интересное, что значимой связи продолжительности жизни у людей с длинными теломерами ученые не нашли. То есть если ваши теломеры длиннее нормы – вы, скорее всего, будете меньше сталкиваться с проблемами сердечно-сосудистой системы, но с большей вероятностью заболеете раком. А сколько проживете – зависит, по всей видимости, от других факторов.
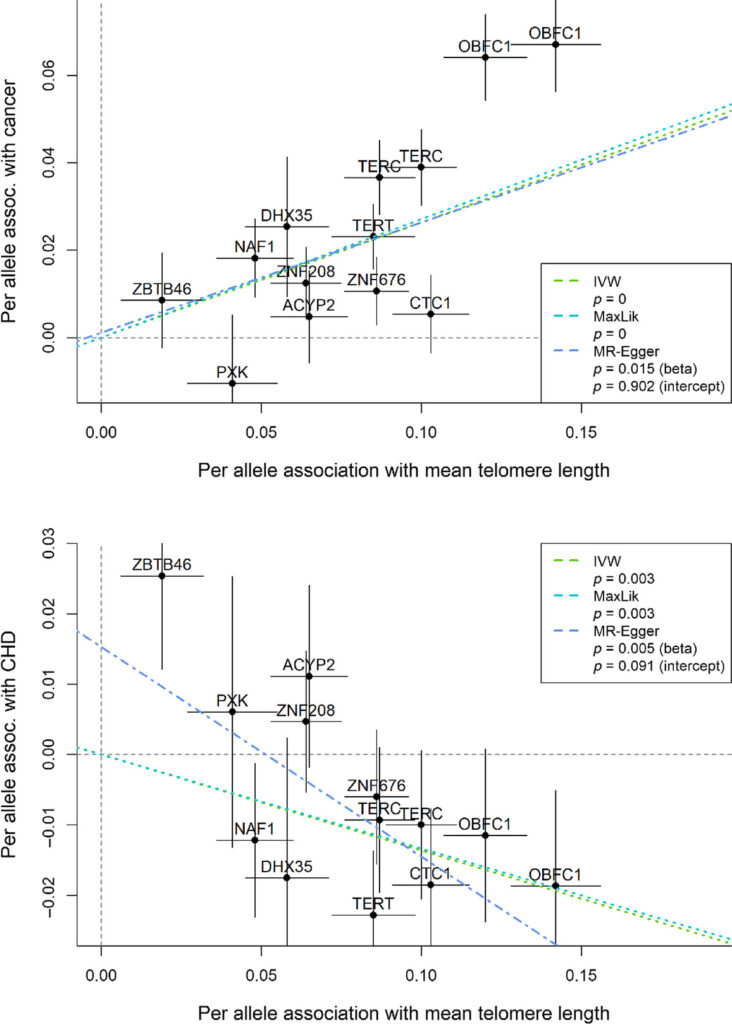
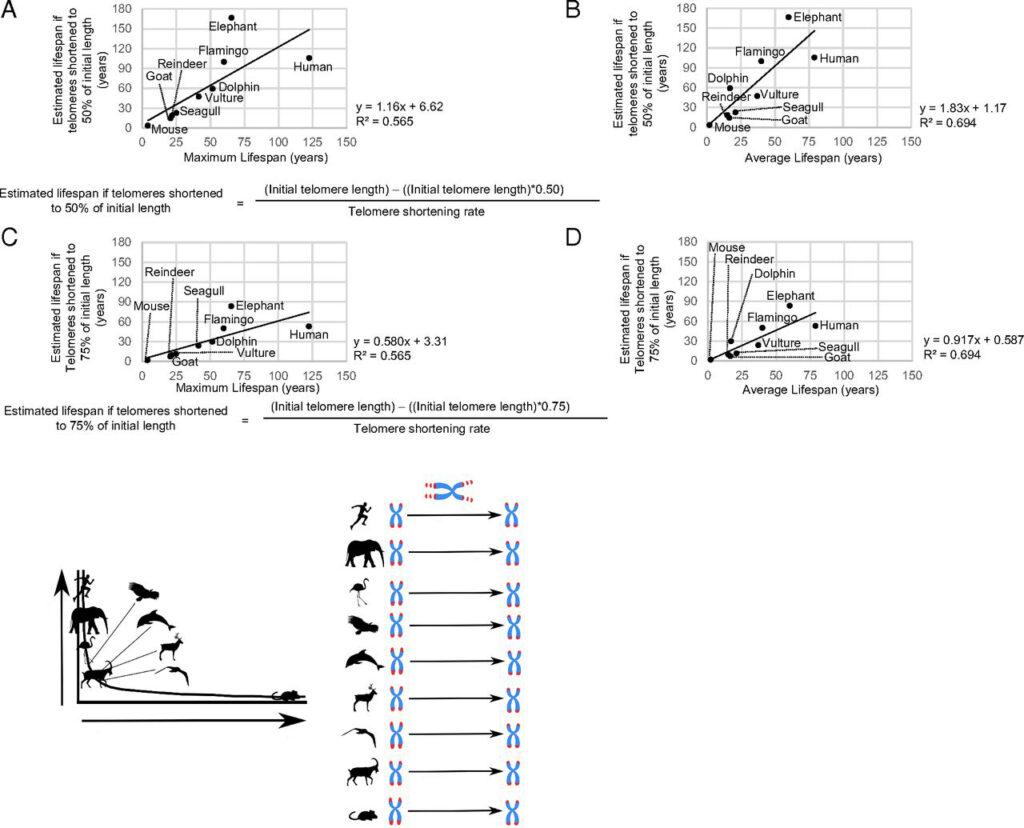
Но все же есть как минимум один важный параметр теломер, который явно связан с продолжительностью жизни. Речь о скорости укорочения этих концевых участков хромосом. Как показала работа испанских ученых, опубликованная в издании Proceedings of the National Academy of Sciences, этот показатель позволяет оценить длительность жизни существа точнее, чем абсолютная длина теломер, изменения сердечного ритма или масса тела.
В этом исследовании ученые измерили скорость сокращения концевых участков хромосом у девяти различных видов животных: домашней козы, домовой мыши, дельфина-афалины, красного фламинго, суматранского слона, белоголового сипа, чайки Одуэна, северного оленя и человека. Ученые считали корреляцию быстроты укорочения теломер в одноядерных клетках крови перечисленных видов с продолжительностью жизни, массой тела и интенсивностью метаболизма (последняя рассчитывалась по частоте сердцебиения).
Как и в предыдущем упомянутом нами исследовании, то, насколько длина теломер выбивалась из средних для определенного вида параметров, никак не влияло на продолжительность жизни животного. А вот скорость сокращения теломер вполне хорошо предсказывала этот параметр. Как отмечают авторы, это подтверждает гипотезу, согласно которой продолжительность жизни зависит от того, в какой момент теломеры укоротятся настолько, что хромосомы потеряют важную генетическую информацию.
Новый объект интереса
Сейчас интересы ученых-геронтологов постепенно смещаются с теломеразы и продления жизни как таковой на другие биологические механизмы и показатели. Если не получится гарантированно увеличить срок жизни человека до 100, 120 или 150 лет, возможно, есть способы улучшить качество жизни в последние годы – пусть даже человек при этом проживет «всего» 80 лет.
Ни для кого не секрет, что последние годы жизни зачастую становятся настоящим мучением. Огромное количество сердечно-сосудистых, метаболических, аутоиммунных, злокачественных и дегенеративных заболеваний развиваются с возрастом. Конечно, многие исследователи пытались найти способ воспрепятствовать этому. Однако долгое время причина развития этого комплекса оставалась неясной.
Основной причиной развития группы старческих патологий называют системное хроническое воспаление, развивающееся с возрастом. Среди многочисленных кандидатов на роль возбудителя хронического воспаления наибольшую научную поддержку получила теория сенесцентных клеток (СК). В 2011 году свершился прорыв в этой области, когда команда под руководством Джеймса Киркланда и Яна ван Дурсена из Майо-клиники показала, что удаление клеток, несущих один из маркеров СК у мышей – так называемый белок p16, участвующий в контроле жизненного цикла клеток, – приводит к частичному омоложению особей.
Результаты последующих исследований подтвердили, что именно сенесцентные клетки являются основной причиной старения, и задали ясное направление поиска лекарств против старения среди «сенолитиков», способных избирательно удалять из организма СК, которые считаются «источником дряхлости».
Впоследствии более детальное изучение проблемы «сенолитиков» показало, что в то время, как все СК несут на себе маркер р16, не все клетки, на мембране которых экспрессируется такой белок, сенесцентны. Большую их часть составляют совсем другие структуры иммунной системы – макрофаги, ответственные за удаление сенесцентных клеток из организма. Таким образом, можно предположить, что с возрастом происходит не только накопление СК, но и нарушение работы иммунной системы, способной в молодом возрасте самостоятельно удалять СК, предотвращая развитие воспаления.
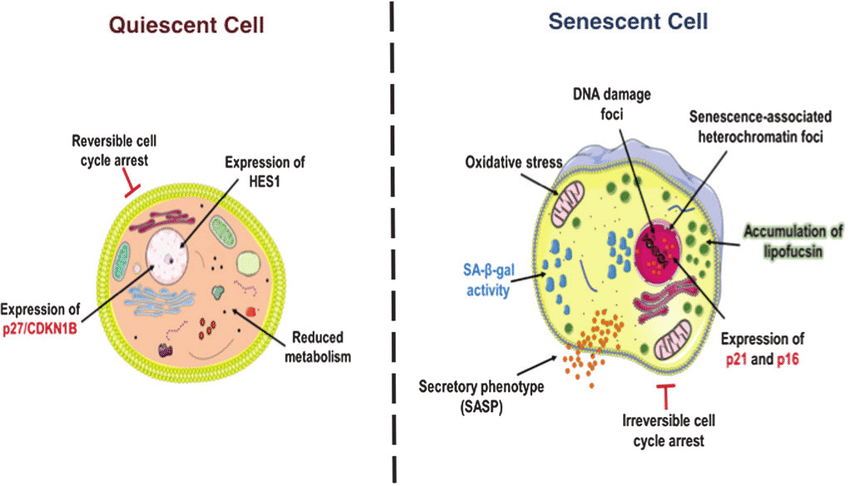
Тот факт, что по крайней мере часть клеток, считавшихся СК, оказались макрофагами, не противоречит теории «хронического воспаления» и никоим образом не меняет важности результатов ранее проведенных исследований. Новые данные лишь скорректировали курс движения разработки противовозрастных препаратов в сторону лучше охарактеризованной мишени и большего понимания процессов, происходящих в стареющем организме.
Определение «хронического воспаления» как связующей нити между всеми заболеваниями, связанными с возрастом, стало серьезным достижением в процессе разработки лекарства от старости. Впервые в истории геронтологии большинство специалистов, представлявших различные сферы науки о старении, приходят к согласию. Эта концепция имеет чрезвычайно важные последствия не только потому, что помогает назвать общую причину всех старческих недугов, но и потому, что позволяет выявить мишень для терапии – накапливающиеся с возрастом клетки.
Полезные уроки
Еще совсем недавно теломеры считались главным способом продления жизни человека. Сегодня, кажется, наступает «первая теломерная зима»: все, что можно было сделать при помощи «фермента бессмертия», уже сделали. Очевидно, теломераза не указывает путь к долгой жизни: она лишь помогает нам узнать свои лимиты, понять, что срок жизни зажат между ранним старением и бесконтрольным образованием опухолей.
Внимание ученых постепенно переключается на другие способы борьбы со старением и продления жизни. Сенесцентные клетки, различные диеты, медицинские препараты – не до конца изученных способов добавить человеку лет еще очень много. Что же будет с теломерой? Возможно, на какое-то время из надежды для человечества она превратится в игрушку для ученых: странно, но это в некотором смысле неплохо.
Меньше спекуляций позволят ей снова быть «просто» важным элементом для биологических, биохимических и генетических исследований. Не каждому из тех, кто дочитал статью до конца, было легко (и, давайте признаемся, даже интересно) читать раздел о механике работы. Иногда «перегретые» всеобщим интересом области нуждаются в некотором покое, чтобы из мишени для надежд и мошенников снова стать частью чистой науки. Конечно, жаль, если эта дорога к бессмертию окажется в итоге тупиком. Но что поделаешь: из опыта работы с теломеразой можно извлечь много полезных уроков. Вполне возможно, что через год или десять лет новое открытие в области хромосомной генетики взорвет научный мир и поднимет новую волну интереса к теломерам и их особенностям. Но пока, кажется, рецепты от старости нужно искать в другом месте.
В ноябре 2025 года при взлете российской ракеты с Байконура к МКС с существенной высоты упала кабина обслуживания 8У216. Поскольку в 2010-х годах из экономии средств у нас отказались от дублирования стартовых площадок, это создало ситуацию временной невозможности пилотируемых полетов. Теперь, всего через три месяца после происшествия, «Роскосмос» смог решить проблему, поставив запасную кабину обслуживания, найденную на складах Минобороны. Весенние пуски к МКС, запланированные ранее, теперь имеют шансы пройти в срок.
Исследователи из Пенсильванского университета напрямую зафиксировали и измерили коронные разряды на листьях деревьев во время прохождения грозового фронта. Ученые выяснили, что под воздействием сильного электрического поля кроны деревьев покрываются тысячами невидимых искр, которые работают как природный ионизатор и очищают атмосферу.
Яд перуанского зеленого бархатного тарантула Thrixopelma pruriens содержит токсин ProTx-I, который избирательно блокирует ряд каналов на мембране клетки. Поэтому токсин может стать новым анальгетиком, однако сначала нужно научиться получать его в больших количествах и в правильной форме. Новое исследование ученых Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова РАН и МФТИ с коллегами из других научных центров России и Китая сравнило методы наработки ProTx-I в бактериях.
В той части Пиренеев, которые находятся на территории Испании, исследователи обнаружили первые доказательства добычи золота в эпоху Римской империи. На месте древних рудников нашли сложные гидравлические сооружения и остатки водохранилища, возраст которых определили с помощью метода оптического датирования. Открытие прольет свет на инженерные приемы римлян и поставит точку в многолетнем споре: действительно ли римляне добывали золото в этом регионе.
В мире оказалось гораздо больше диких пчел, чем кто-либо мог предположить. Ученые впервые оценили, сколько видов пчел существует на Земле, и обнаружили, что показатель превышает 26 тысяч — примерно на четверть больше, чем считалось.
Разное отношение домашних животных к хозяевам давно стало предметом споров, обсуждений и шуток. Ученые из Венгрии показали, что собаки демонстрируют по отношению к человеку уровень альтруизма, сходный с детским, тогда как кошки ищут в партнерстве с человеком прежде всего свою выгоду.
Астрономы недавно проанализировали базу данных о падающих на Землю объектах и пришли к выводу, что два из них прибыли из межзвездного пространства. Известна не только дата, но и место падения каждого из них.
«Любить лишь можно только раз», — писал поэт Сергей Есенин, а герои культовых сериалов приходили к выводу, что «настоящая» влюбленность случается в жизни максимум дважды. Однако ни один из этих тезисов не подкреплен научными данными. Американские исследователи подошли к вопросу иначе: опросили более 10 тысяч человек и вывели среднее число сильных влюбленностей, возможных в течение жизни.
В той части Пиренеев, которые находятся на территории Испании, исследователи обнаружили первые доказательства добычи золота в эпоху Римской империи. На месте древних рудников нашли сложные гидравлические сооружения и остатки водохранилища, возраст которых определили с помощью метода оптического датирования. Открытие прольет свет на инженерные приемы римлян и поставит точку в многолетнем споре: действительно ли римляне добывали золото в этом регионе.

Вы попытались написать запрещенную фразу или вас забанили за частые нарушения.
Понятно
Из-за нарушений правил сайта на ваш аккаунт были наложены ограничения. Если это ошибка, напишите нам.
Понятно
Наши фильтры обнаружили в ваших действиях признаки накрутки. Отдохните немного и вернитесь к нам позже.
Понятно
Мы скоро изучим заявку и свяжемся с Вами по указанной почте в случае положительного исхода. Спасибо за интерес к проекту.
Понятно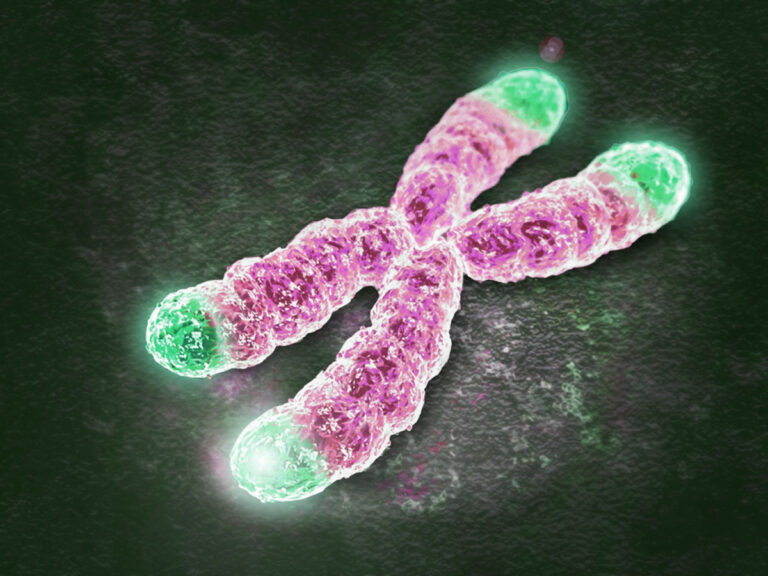







Последние комментарии