Уведомления
Авторизуйтесь или зарегистрируйтесь, чтобы оценивать материалы, создавать записи и писать комментарии.
Авторизуясь, вы соглашаетесь с правилами пользования сайтом и даете согласие на обработку персональных данных.
Биохимики вскрыли механизм устойчивости бактерий к антибиотикам
Группа американских биохимиков выяснила, что механизм одного из клинически значимых типов антибиотикорезистентности оказался сложнее, чем считалось ранее. Также ученые поняли, что именно позволяет некоторым антибиотикам эффективно воздействовать на устойчивые бактерии.
Больше половины всех антибиотиков, используемых для лечения бактериальных инфекций, блокируют работу рибосом, синтезирующих белки в клетках. В результате этого нарушения или даже полной блокировки бактерии перестают расти либо гибнут. Но некоторые виды патогенных микроорганизмов приспособились и выработали механизмы защиты от подобных лекарств. Такие бактерии называют антибиотикорезистентными. И проблема устойчивости патогенов сейчас стоит крайне остро.
Один из подобных механизмов защиты устроен так. Ген cfr в бактериальных клетках производит специальный фермент — метилтрансферазу Cfr. Она модифицирует сайт связывания антибиотика с патогеном. Как считалось ранее, эта модификация просто блокировала сайт в рибосомах, отчего лекарство не могло соединиться с бактерией и не срабатывало. Но исследователи из Иллинойса вместе с коллегами из Гарварда (США) с помощью рентгеноструктурного анализа модифицированной рибосомы выяснили, что механизм защиты бактерий от антибиотиков метилтрансферазой Cfr гораздо сложнее. Статья об этом опубликована в журнале Nature Chemical Biology.
Чтобы понять, почему метилирование одного нуклеотида в рибосоме приводит к блокировке, исследователи определили структуру модифицированной органеллы со структурой немодифицированной. Выяснилось, что Cfr-модификация по-разному влияет на связывание антибиотиков из разных классов. Например, в случае линкозамидов и стрептограминов типа А модификация рибосомы мешает химической реакции стерически, то есть пространственно перекрывает сайт. Но в случае с фениколами и оксазолидинонами антибиотик не может связаться с рибосомой потому, что место связывания перестраивается и нуклеотиды смещаются. Такой эффект в биохимии называют аллостерическим.
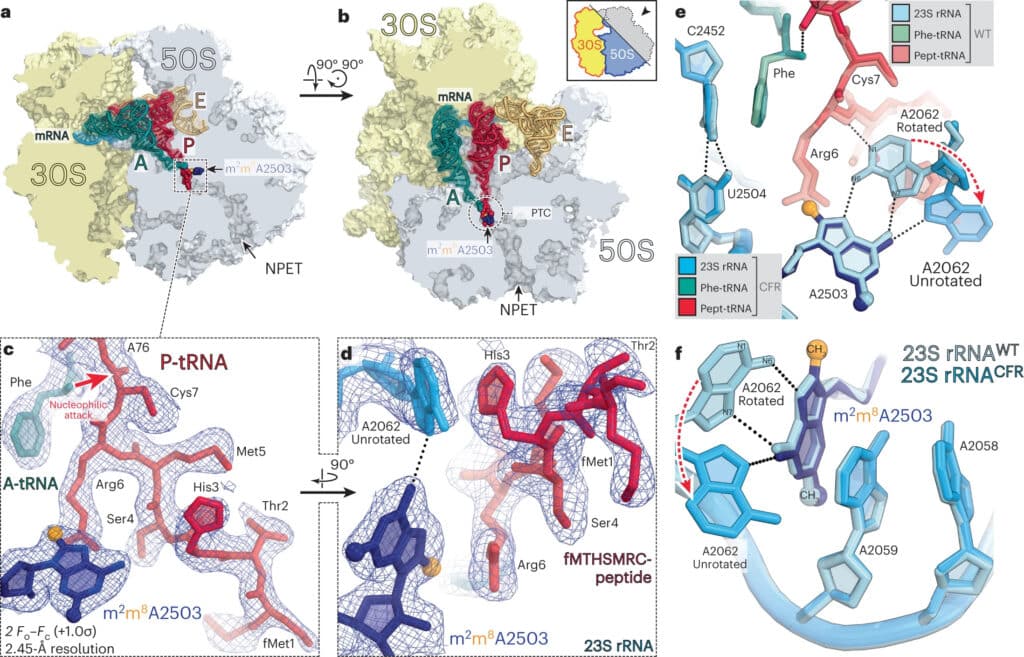
Также исследователи выяснили, что некоторые антибиотики способны преодолевать этот тип бактериальной устойчивости. Для этого они определили трехмерные структуры резистентной модифицированной рибосомы вместе с недавно синтезированным антибиотиком ибоксамицином (IBX). Антибиотик был связан с метилированными рибосомами модельной грамотрицательной бактерии Thermus thermophilus. Ее устойчивость обеспечивал именно ген cfr. Теоретически IBX не должен связываться с модифицированными рибосомами, но тот факт, что антибиотик успешно подавляет рост патогенных бактерий, говорит об обратном.
Авторы исследования выяснили, что ибоксамицин связывается с бактериальной рибосомой настолько сильно, что даже метилированный нуклеотид A2503, который должен препятствовать работе антибиотика, никак не мешает. Он сдвигается в сторону, позволяя молекуле ибоксамицина соединяться с модифицированной рибосомой точно так же, как с обычной.
«Он просто связывается с рибосомами и действует так, как будто ему все равно, было это метилирование или нет. Он легко преодолевает несколько наиболее распространенных типов лекарственной устойчивости», — отметил соавтор работы Юрий Поликанов.
Как считают исследователи, важность таких открытий состоит в том, что подобное поведение нуклеотидов невозможно предсказать без трехмерных структур. А понимание двухкомпонентного механизма защиты бактерий и модель модифицированной рибосомы могут помочь в создании антибиотиков нового поколения, активных против патогенов с множественной устойчивостью.
Специалисты Института истории материальной культуры (ИИМК) РАН в ходе раскопок некрополя Артющенко-2 в Темрюкском районе Краснодарского края обнаружили первые для данного памятника грунтовые склепы на некрополе Артющенко-2. Один из склепов содержал в себе останки не менее 7 человек, в том числе ребенка.
Коллектив ученых из лаборатории искусственных квантовых систем МФТИ, Института радиотехники и электроники им. В. А. Котельникова РАН и Сколтеха провел уникальный эксперимент, в котором исследовал явление резонансной флуоресценции в трехуровневой системе. На систему воздействовали сразу два источника излучения.
Особая физиологическая чувствительность к музыке, стихам, картинам, когда на пике удовольствия по коже бегут мурашки, может быть заложена в генах и передаваться по наследству, пришли к выводу ученые.
Ученые проверили 100 популярных кормов для собак и кошек и во многих из них нашли ПФАС, так называемые «вечные химикаты», причем одни из самых высоких концентраций обнаружили в продуктах на основе рыбы. Во многих случаях их уровень превышает пороги безопасности для людей, установленные европейским регулятором.
Оказалось, что насекомые активно избегают влажных поверхностей.
Специалисты Института истории материальной культуры (ИИМК) РАН в ходе раскопок некрополя Артющенко-2 в Темрюкском районе Краснодарского края обнаружили первые для данного памятника грунтовые склепы на некрополе Артющенко-2. Один из склепов содержал в себе останки не менее 7 человек, в том числе ребенка.
Астрономы недавно проанализировали базу данных о падающих на Землю объектах и пришли к выводу, что два из них прибыли из межзвездного пространства. Известна не только дата, но и место падения каждого из них.
Международная команда палеонтологов описала новый вид динозавра размером с крупную современную птицу. Он носил на голове плотный костяной нарост, который эти животные, возможно, использовали для внутривидовых разборок. Находка показывает, что даже мелкие хищники мелового периода могли решать конфликты не только когтями и зубами, но и ударами головой.
Образцы грунта, взятые астронавтами полвека назад, вложили еще один важный кирпич в здание научной картины мира: гипотеза о том, что Земля исходно была сухой, не стыкуется с фактами. Похоже, идею о невозможности сохранения большого количества воды на «теплых» планетах придется пересмотреть.

Вы попытались написать запрещенную фразу или вас забанили за частые нарушения.
Понятно
Из-за нарушений правил сайта на ваш аккаунт были наложены ограничения. Если это ошибка, напишите нам.
Понятно
Наши фильтры обнаружили в ваших действиях признаки накрутки. Отдохните немного и вернитесь к нам позже.
Понятно
Мы скоро изучим заявку и свяжемся с Вами по указанной почте в случае положительного исхода. Спасибо за интерес к проекту.
Понятно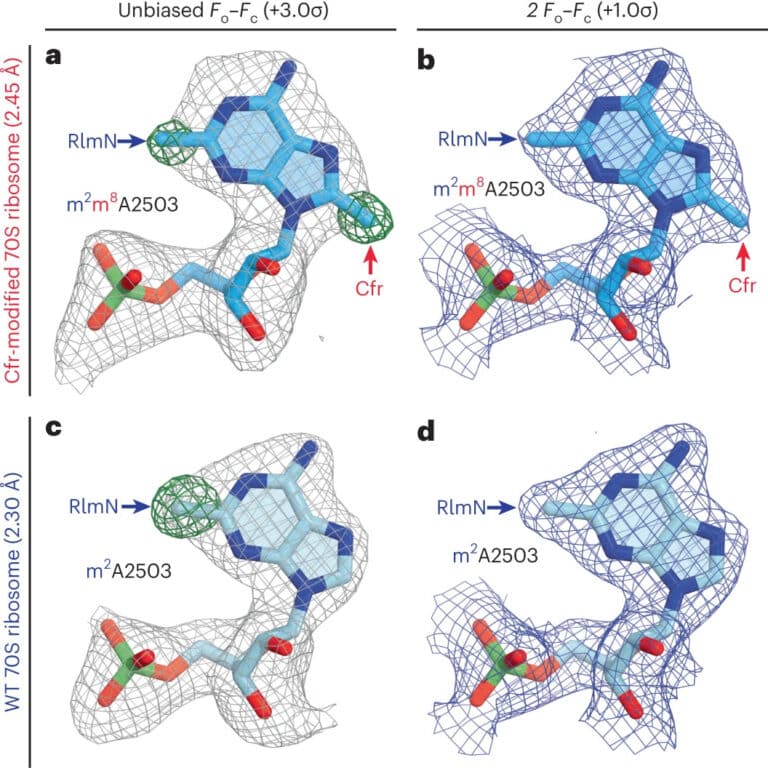







Последние комментарии