Уведомления
Авторизуйтесь или зарегистрируйтесь, чтобы оценивать материалы, создавать записи и писать комментарии.
Авторизуясь, вы соглашаетесь с правилами пользования сайтом и даете согласие на обработку персональных данных.
Как исправить человека. CRISPR/Cas9: новейшая система генной модификации, которая обещает изменить нашу жизнь
Фантастические, пугающие многих истории о вмешательстве в человеческий геном долгие годы оставались именно фантастическими. Практичных методов изменить ДНК, с добрыми или иными намерениями, не существовало. Но теперь такой метод есть: заимствованная у бактерий система CRISPR/Cas9 позволяет вести генетическую модификацию любых организмов с такой точностью и эффективностью, о которой прежде можно было лишь мечтать. И вот уже китайские медики объявили о планах первого целенаправленного редактирования ДНК человека. Вмешательство в наш геном уже не фантастика. Но так ли это пугает?
Иммунитет
– естественный «иммунитет» бактерий, биохимическая система защиты от вирусов, которая требуется одноклеточным организмам, неспособным поддерживать такую сложную иммунную систему, как наша. Первые намеки на ее существование были найдены еще в конце 1980-х, когда Йошизуми Исино и его коллеги исследовали обыкновенную кишечную палочку, точнее говоря, один ее малопримечательный ген (iap).
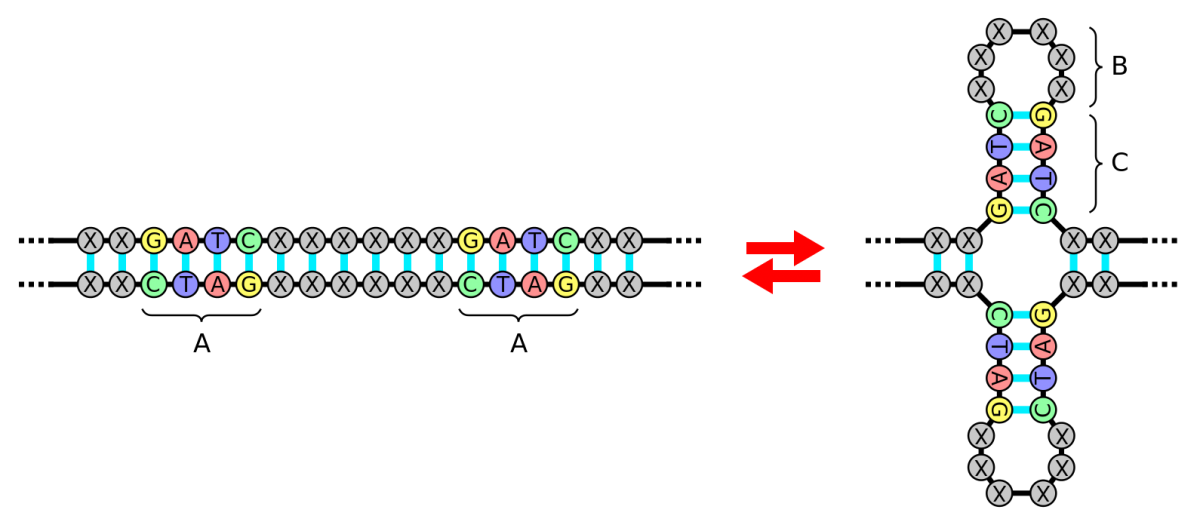
На всякий случай японцы секвенировали его последовательность вместе с участками по бокам от него: может, там будут какие-то фрагменты, участвующие в регуляции активности iap?.. Вместо этого биологи обнаружили в ДНК длинные последовательности повторяющихся, совершенно идентичных повторов длиной ровно 29 нуклеотидов. Между ними – как сухие растения между листами бумаги в гербарии – оказались «проложены» короткие фрагменты длиной по 32 нуклеотида, которые не повторялись никаким образом.
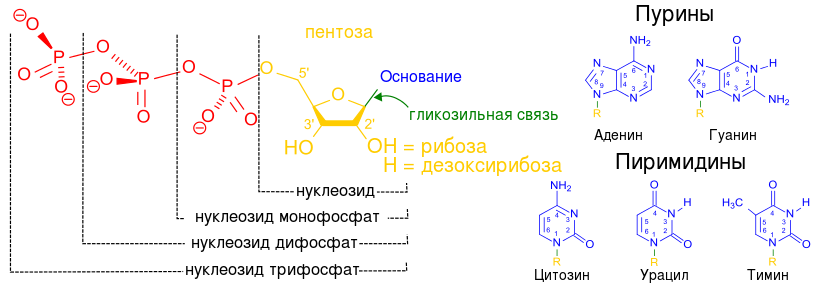
Позднее эту странную часть ДНК назвали «регулярно сгруппированные, разделенные короткие палиндромные повторы» – Clustered Regularly Interspaced Short Palindromic Repeats. В остальном работы над ними надолго остановились, хотя многие ученые заинтересовались загадочными участками хромосомы, а некоторые даже рассуждали об их роли. Функциональное значение CRISPR оставалось загадкой, да и особенных прорывов никто от них не ждал: «Биологическое значение этих последовательностей неясно», – написал тогда Исино с соавторами.
Однако во второй половине 1990-х начался настоящий бум секвенирования. Установить последовательность ДНК становилось все проще, и геномы все новых и новых организмов стали пополнять компьютерные базы данных и анализироваться со всех сторон. Таинственная – и вроде бы бессмысленная, совершенно не похожая ни на какой ген – последовательность CRISPR обнаруживалась у бактерий повсеместно. Нидерландский биолог Рууд Янсен заметил, что они всегда соседствуют с генами одних и тех же белков. Функции их тогда были тоже неизвестны, и их назвали просто «белками, ассоциированными с CRISPR» (CRISPR-Associated Proteins, Cas).
И лишь в 2005 году сразу три группы исследователей сообщили, что уникальные участки CRISPR – это фрагменты вирусных геномов. «Тут у меня что-то щелкнуло», – вспоминал впоследствии всемирно известный биоинформатик и эволюционист Евгений Кунин. К тому времени он уже несколько лет бился над загадкой CRISPR – и, наконец, его озарило: эта ДНК может быть частью противовирусной защиты бактериальной клетки.
Эта идея понравилась микробиологу Родольфу Баррангу, который в то время работал в компании Danisco, производящей йогурты. В этом бизнесе вирусная эпидемия среди молочнокислых бактерий способна принести серьезные убытки, и исследователь искал методы защиты от нее. Чтобы проверить гипотезу Кунина, он заразил стрептококков Streptococcus thermophilus двумя штаммами бактериофагов. Большинство бактерий погибло, однако выжившие оказались довольно устойчивы к этим вирусам. Секвенировав их ДНК, ученые подтвердили: в ней появились следы встречи.
Инструмент
Дженнифер Дудна и Блейк Виденхефт взялись за изучение структуры белков Cas: к этому моменту выяснилось, что они выполняют роль нуклеаз, то есть разрезают ДНК. Несмотря на все находки, значение открытия по-прежнему было неясным: «У вас нет никакой определенной практической цели, – объясняла Дудна работавшему в ее лаборатории Виденхефту. – Важно лишь понять, как это работает». Но по мере работы выяснились многие удивительные детали.
CRISPR – это, действительно, нечто вроде гербария, каталог, в котором бактериальная клетка сохраняет образцы, фрагменты геномов вирусов, с которыми доводилось сталкиваться ей или ее предкам. Пользоваться этим каталогом могут специальные белки, ассоциированные с CRISPR (CRISPR-Associated Proteins, Cas). Ориентируясь на эти образцы, они быстро распознают новые вирусные гены и разрезают их, выводя из строя.
Биолог Карл Циммер объясняет работу системы CRISPR/Cas так: «По мере того, как область CRISPR заполняется вирусной ДНК, она становится ключевой «галереей» в клетке, где представлены «портреты» микробов, с которыми бактерии доводилось встречаться. Впоследствии эта вирусная ДНК может использоваться для «наведения» точного орудия Cas-белков».
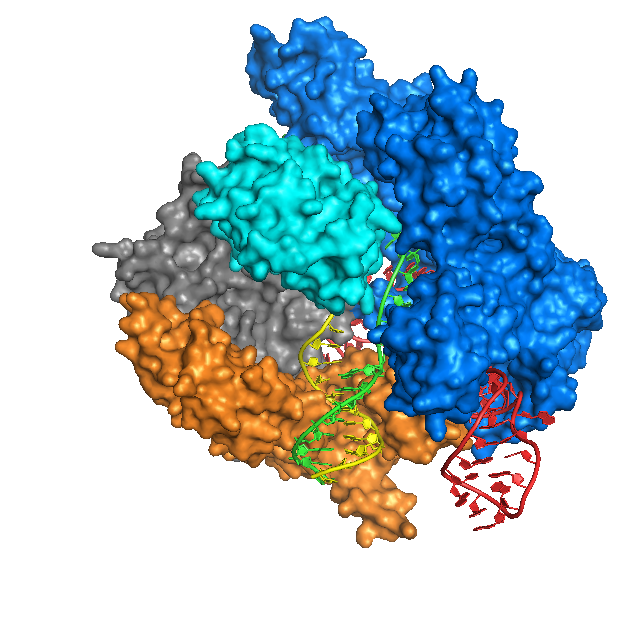
Для этого бактериальная клетка синтезирует на сохраненных фрагментах ДНК короткие образцы, молекулы РНК. Каждый из этих РНК-«гидов» (гРНК) связывается с белком Cas, способным разрезать ДНК, подходящую под этот образец. Эти комплексы постоянно патрулируют клетку, отслеживая появление любой ДНК и сопоставляя ее с гРНК. Если совпадение есть, двойная спираль ДНК тут же разрезается на части и инактивируется. «Как только мы осознали Cas в качестве программируемых, разрезающих ДНК ферментов, произошел интересный момент, – вспоминала впоследствии Дженнифер Дудна. – Мы воскликнули: «Боже, да это же может быть инструментом!»»
Сегодня определено целое семейство белков Cas, но наиболее изученным и освоенным оказался протеин Cas9, выделенный из бактерий Streptococcus pyogenes – возбудителей скарлатины. Именно он лег в основу новейшей методики генетической модификации живых организмов CRISPR/Cas9, методики, обещающей невиданный прорыв в биотехнологиях, сельском хозяйстве и медицине.
Модификация
В самом деле, белок Cas9 – это нуклеаза, то есть фермент, разрезающий ДНК. Для любого метода генетической модификации – удаления или добавления целевых активных генов в организм – эта способность играет ключевое значение. Чтобы копировать и вставлять, нужно вырезать, причем делать это в строго определенном месте. До сих пор с точностью у генетиков были проблемы.
Вспомним, что молекула ДНК – это, по молекулярным меркам, невероятно длинная цепочка, общая длина которой в каждой хромосоме каждой нашей клетки достигает порядка сантиметров. Разнообразием этот полимер не отличается, состоя всего из четырех разных звеньев: аденина (А), гуанина (Г), тимина (Т) и цитозина (Ц), которые повторяются миллионы и миллионы раз. Найти в этом однообразии именно нужный участок неимоверно сложно.
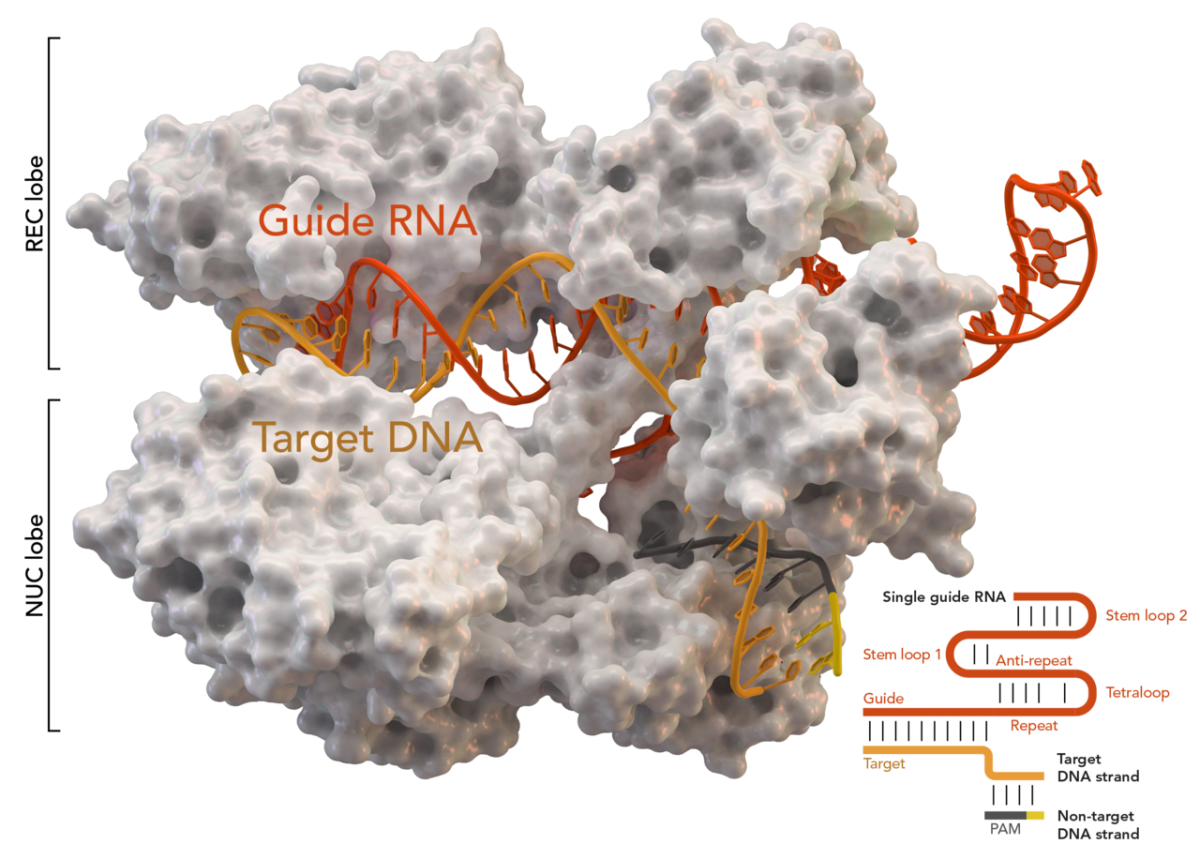
Долгое время в распоряжении генетиков имелись лишь системы с нуклеазами, которые распознавали короткие участки – например, четыре нуклеотида АТЦЦ или ТГЦА, – которых на протяжении цепочки могут встречаться десятки и сотни. В результате разрезы производились в случайном из этих мест, и лишь кропотливая работа позволяла отобрать клетки, в которых этот процесс прошел в нужном участке генома. В отличие от них, вооруженный гРНК белок Cas9 распознает фрагмент длиной с эту РНК – около 20 нуклеотидов. Такие участки уже, как правило, вовсе не повторяются в ДНК даже высших организмов.
Более того, сама структура комплекса Cas9 с гРНК определяет простоту работы с ней. Достаточно открыть в компьютере базу с ДНК нужного организма, найти фрагмент, который должен быть разрезан, и синтезировать молекулы гРНК с той же последовательностью оснований (и заменой тимина, роль которого в РНК играет урацил, У). Cas9 – нуклеазы неразборчивые и будут резать ДНК где угодно, лишь бы гРНК совпала.
В отличие от этого, системы генетической модификации предыдущих поколений требовали долгой работы по проектированию и синтезу ферментов-нуклеаз, способных распознавать определенные участки ДНК. Например, методы с использованием связывающихся с ДНК «цинковых пальцев» ZFN (Zinc Finger Nuclease) или белков TALEN (Transcription Activator-Like Effector Nucleases) теоретически позволяют работать с еще более длинными фрагментами ДНК. Однако для каждой конкретной задачи их приходится проектировать отдельно.
Наконец, CRISPR/Cas9 универсален по отношению к разным видам модифицируемых организмов. Метод прост и эффективен и, по крайней мере, теоретически с одинаковым успехом подходит для получения риса с повышенным содержанием витамина А или лосося, набирающего массу вдвое быстрее обычного, для внесения новых генов или замены дефектных у племенных лошадей и людей… Но прежде чем перейти к людям, давайте «потренируемся на кошках». А лучше – на мышах.
Мыши, люди и все-все-все
Представим, что нам требуется получить мышей-альбиносов, чтобы изучить, как влияет это состояние на здоровье разных систем организма у людей. Для этого следует «выключить» обе копии гена, связанного с синтезом пигмента меланина. Если мы привержены традиционным подходам к генетической модификации (кстати, по большей части тоже заимствованным у бактерий), то нам стоит запастись терпением.
Для начала нам следует синтезировать «ген альбиносости» и получить мышиные эмбрионы на самых первых этапах развития. Затем в их ядра через тончайшую полую стеклянную иглу внести новую ДНК. В делящихся клетках происходит рекомбинация – обмен гомологичными участками хромосом – так что, трижды сплюнув, будем надеяться, что она захватит и нужный нам фрагмент. Методом проб и ошибок, бесконечными повторами и отбраковыванием мы можем получить мышей, которые получили одну копию «гена альбиносости» и оказались способны передать ее потомству. Затем, скрещивая таких животных, рано или поздно мы добьемся рождения особей с заменой обеих копий. Можно выжидать, а лучше сразу переходить на CRISPR/Cas9.

Действительно, чтобы получить тех же мышей-альбиносов, достаточно найти пограничные участки нашего целевого гена и синтезировать для них гРНК, после чего ввести в эмбрион вместе с белками Cas9 и ДНК нового гена. Подхватив гРНК, нуклеазы Cas9 разрежут обе копии гена по краям, после чего в дело включатся клеточные системы репарации, ответственные за поддержание целостности генома.
Это чрезвычайно ответственная задача, поэтому белки репарации действуют быстро и даже грубо. Обнаружив повреждение ДНК – тем более такое опасное, как двухцепочечный разрез, – они готовы подхватить первый попавшийся кусок ДНК, буквально «затыкая» образовавшуюся брешь. Так что если в клетке окажется достаточно нужных нам фрагментов, в место, разрезанное белками Cas9, будут встроены они.
Недаром за прошедшее с момента открытия CRISPR/Cas9 генетическая модификация совершает прорыв за прорывом. Громкое заявление китайских биологов – тому лишь один из примеров. КНР остается страной с одним из самых мягких законодательств в области генной инженерии. Даже в Великобритании, где разрешены эксперименты по применению CRISPR/Cas9 на человеческих эмбрионах, получившихся химер требуется уничтожать в возрасте не старше 14 суток. В Китае дозволяется куда больше.
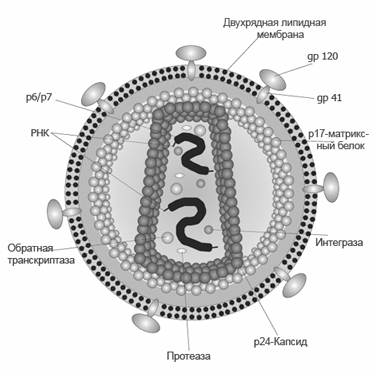
Такие работы невероятно перспективны: буквально в последние годы показано, что CRISPR/Cas9 позволяет редактировать гены даже во взрослом организме, очищая ДНК Т-лимфоцитов от заразившего их ВИЧ. А в том же Китае ученые (не слишком успешно) пытались получить эмбрионы, устойчивые к этой инфекции. Теперь же речь идет о борьбе с раком. Для этого медики планируют отредактировать ДНК тех же Т-лимфоцитов – точнее говоря, ген белка PD-1, который в норме держит их под контролем.
Активный ген PD-1 блокирует способность Т-лимфоцитов атаковать собственные клетки организма и предотвращает развитие аутоиммунных заболеваний. Однако в случае рака такая способность пришлась бы очень к месту, и ученые собираются, забрав клетки у реальных онкологических больных, изменить ген PD-1 с помощью CRISPR/Cas9 (теперь мы в общих чертах понимаем, как это можно сделать). Вернув в организм эти лимфоциты, авторы ожидают, что те начнут размножаться и атаковать опухоль.
Рак и ВИЧ – лишь пара громких примеров. Однако в будущем CRISPR/Cas9 и генетическая модификация позволят избавиться от множества других болезней. Тем более что множество тяжелейших состояний связаны с нарушением в работе всего одного гена: их, видимо, исправить будет куда проще, чем вылечить тот же рак. В отличие от них, доброта и ум, красота или спортивные способности – продукт работы массы разных генов, воспитания и других факторов среды. Так что CRISPR/Cas9 принесет лишь пользу, а использовать ее во вред вряд ли получится. Разве что просто попугать.
Ученые проверили 100 популярных кормов для собак и кошек и во многих из них нашли ПФАС, так называемые «вечные химикаты», причем одни из самых высоких концентраций обнаружили в продуктах на основе рыбы. Во многих случаях их уровень превышает пороги безопасности для людей, установленные европейским регулятором.
Оказалось, что насекомые активно избегают влажных поверхностей.
Во время обследования почти 900 собак ученые выявили 12 пород, склонных к брахицефалическому обструктивному синдрому дыхательных путей, который может ухудшать сон и влиять на переносимость физических нагрузок. Авторы нового исследования выяснили, что список пород, предрасположенных к серьезным нарушениям дыхания, куда шире, чем считалось ранее.
Ученые проверили 100 популярных кормов для собак и кошек и во многих из них нашли ПФАС, так называемые «вечные химикаты», причем одни из самых высоких концентраций обнаружили в продуктах на основе рыбы. Во многих случаях их уровень превышает пороги безопасности для людей, установленные европейским регулятором.
Ученые из Института космических исследований РАН и МФТИ раскрыли химический механизм, объясняющий появление молекул воды на поверхностях астероидов.
Исследователи Санкт-Петербургского государственного университета разработали эффективный способ обнаружения в крови важнейшего биомаркера иммунитета — неоптерина — с помощью нанотехнологий и лазера.
Астрономы недавно проанализировали базу данных о падающих на Землю объектах и пришли к выводу, что два из них прибыли из межзвездного пространства. Известна не только дата, но и место падения каждого из них.
Международная команда палеонтологов описала новый вид динозавра размером с крупную современную птицу. Он носил на голове плотный костяной нарост, который эти животные, возможно, использовали для внутривидовых разборок. Находка показывает, что даже мелкие хищники мелового периода могли решать конфликты не только когтями и зубами, но и ударами головой.
Образцы грунта, взятые астронавтами полвека назад, вложили еще один важный кирпич в здание научной картины мира: гипотеза о том, что Земля исходно была сухой, не стыкуется с фактами. Похоже, идею о невозможности сохранения большого количества воды на «теплых» планетах придется пересмотреть.

Вы попытались написать запрещенную фразу или вас забанили за частые нарушения.
Понятно
Из-за нарушений правил сайта на ваш аккаунт были наложены ограничения. Если это ошибка, напишите нам.
Понятно
Наши фильтры обнаружили в ваших действиях признаки накрутки. Отдохните немного и вернитесь к нам позже.
Понятно
Мы скоро изучим заявку и свяжемся с Вами по указанной почте в случае положительного исхода. Спасибо за интерес к проекту.
Понятно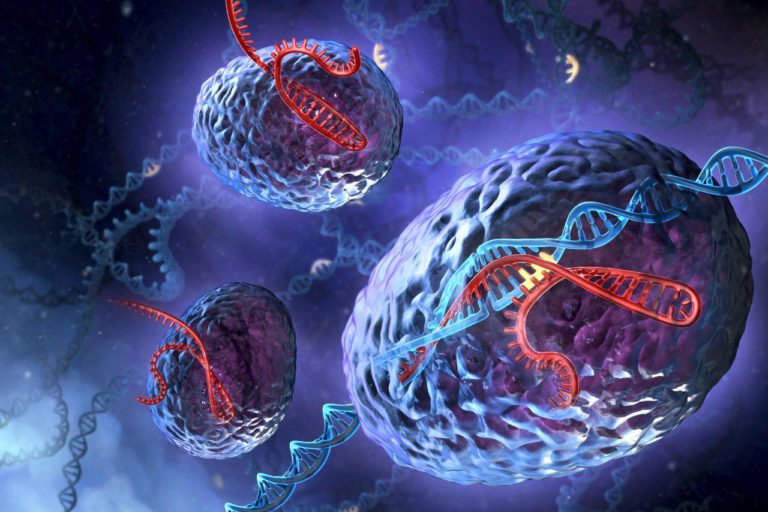




Последние комментарии