Уведомления
Авторизуйтесь или зарегистрируйтесь, чтобы оценивать материалы, создавать записи и писать комментарии.
Авторизуясь, вы соглашаетесь с правилами пользования сайтом и даете согласие на обработку персональных данных.
Ядерная и высокотехнологичная: медицина и атом
В XXI веке мы увидели рассвет технологий в области медицины. Что конкретно сегодня происходит в технологической гонке в этой области? И когда мы избавимся от импорта радиофармпрепаратов? Рассказываем о том, как развивается ядерная медицина и что в этом отношении делают атомщики и медики в нашей стране.
Ядерная медицина — что это?
В основе ядерной медицины лежит использование короткоживущих элементов, которые в процессе распада генерируют ионизирующее излучение. Оно сегодня применяется в радионуклидной и лучевой терапии, а также в лучевой диагностике. Причем лучевое направление отделяется от ядерного в том смысле, что в первом в основном используются линейные ускорители или рентгеновские трубки, которые генерируют рентгеновское излучение, реже источники гамма-излучения, например, из кобальта-60 или цезия-137, а во втором – изотопные источники, которые могли бы нанести удар по опухолевым клеткам и не навредить здоровым.
Данную статью можно прослушать в формате подкаста.
Полномасштабное развитие именно ядерной медицины началось позже, чем лучевой, и сегодня является передним краем в этой отрасли. Почему это приобрело особую актуальность именно сегодня? Вообще, исторически лучевая медицина как массовое явление началась в 1950-х годах, но тогда ключевые ее возможности — борьба с раковыми опухолями — были далеко не так востребованы, как сегодня. Смерть от болезней сердца и сосудов, инфекции в ту пору уносили намного больше жизней, чем рак.
И хотя сегодня сердечно-сосудистые заболевания по-прежнему являются основной причиной смертности во всем мире, порядка 17% всех смертей на Земле – результат рака. Абсолютная цифра огромна – порядка десяти миллионов человек в год. Еще хуже то, что она растет (для всех обществ, у которых в принципе есть обширная медицинская статистика), причем темпами быстрее роста населения Земли.
До недавних пор научпоп объяснял это так: продолжительность жизни людей растет, от этого растет и число тех, кто может получить онкологическое заболевание. По ряду оценок во второй половине этого века средний возраст человечества может перевалить за 50. В подобных условиях подушевая смертность от рака вырастет куда выше современной.
Лучевая и радионуклидная терапии сегодня являются классическими методами лечения онкологических заболеваний. Они зачастую используются в комбинации друг с другом. По различным оценкам, около 50% пациентов нуждаются в методах лучевой терапии.
Неудивительно, что в нашей стране ядерная высокотехнологичная медицина, куда входит и радионуклидное, и лучевое направления — одно из приоритетных направлений научно-технологического развития.
Почему именно в России?
Работы по созданию линейных ускорителей для лучевой терапии были начаты учеными-атомщиками в Научно-исследовательском институте имени Ефремова еще в конце 1950-х годов. В первые десятилетия работы там, в сотрудничестве с ведущими онкологическими центрами страны, создали медицинские ускорители с энергией частиц от 6 до 20 мегаэлектронвольт (ЛУЭ-25, ЛУЭР-15М, ЛУЭР-20М, СЛ75-5-МТ). Была налажена целая серия — более 70 — установок с такими энергиями.
Примерно с того же времени в нашей стране выпускают рентгеновские аппараты различных типов. Физико-энергетический институт им. А.И. Лейпунского (ГНЦ РФ – ФЭИ) и Всероссийский научно-исследовательский институт технической физики имени академика Е. И. Забабахина (РФЯЦ-ВНИИТФ) были пионерами в нейтронной терапии в целом и лечении отдельными видами нейтронов в частности (нейтронно-захватная терапия, терапия быстрыми нейтронами).
За счет наличия в нашей стране крупного реакторного парка, она может нарабатывать практически любые изотопы, используемые в ядерной и высокотехнологичной медицине. Однако кроме собственно наработки изотопа важно еще и дать ему правильную “упаковку” – о которой мы и поговорим далее
Изотоп и препарат на его основе
Технический прогресс в ядерной медицине – сегодня среди ключевых орудий в борьбе с ростом смертности от рака. Куда же она эволюционирует сегодня?
В основе работы любого радиофармацевтического лекарственного препарата (РФЛП) – нестабильный изотоп, имеющий короткий период полураспада. В зависимости от этого РФЛП делятся на диагностические и терапевтические. Например, короткоживущие изотопы широко используются в диагностике. Они двигаются с кровью по организму, давая увидеть, где в нем есть проблемы с кровотоком и где именно находится раковая опухоль и ее метастазы. Примером такого сверхбыстро делящегося изотопа является фтор-18. За счет быстрого периода распада в пару часов, он не оказывает долгосрочного влияния на организм.
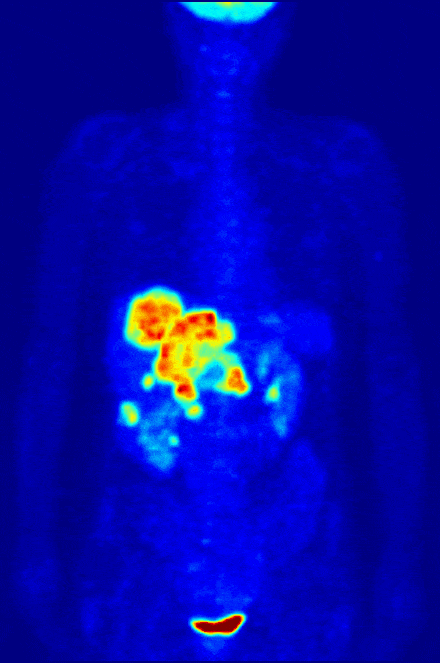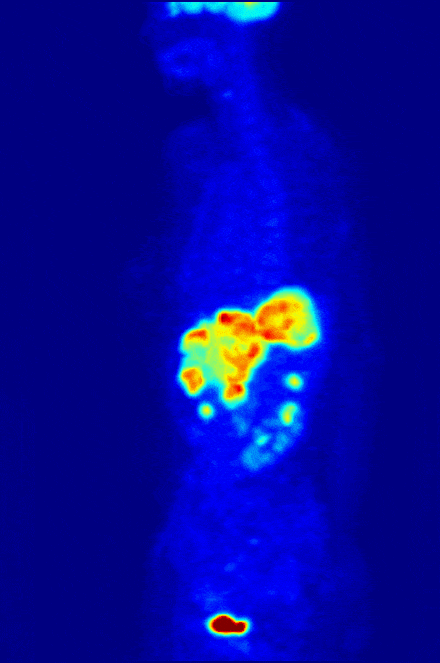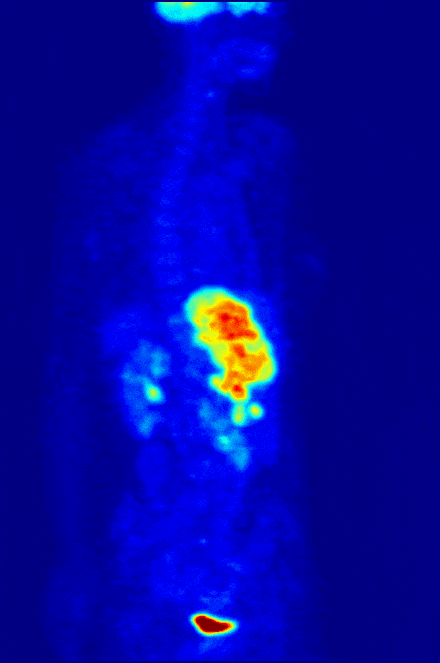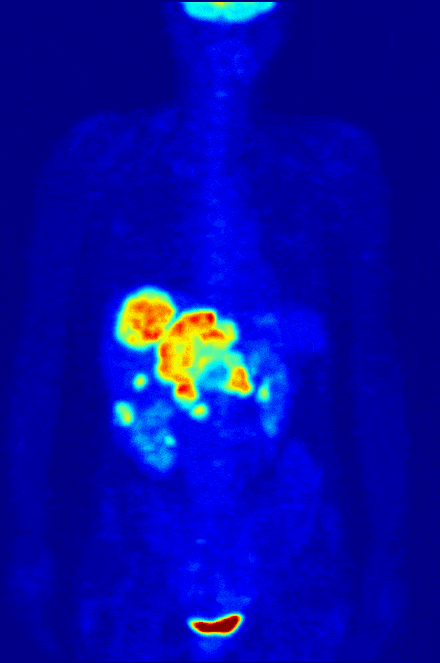
Одной диагностикой рак не победишь, поэтому среди радиофармпрепаратов, разумеется, есть и те, что лечат. Например, радиофармпрепараты на основе изотопа йода вводятся в тело человека в “некапсулированном” виде и способны распространяться по нему “во все стороны”. Наше тело активно и быстро накапливает йод в щитовидной железе, и если кто-то имеет опухоль именно там – радионуклид йода доберется до нее и уничтожит опухоль, не вредя остальном организму.
Важно отметить, что РФЛП на базе радиоактивного йода используют и для диагностики нейробластом у детей. Это позволяет понимать, как идет лечение, нет ли метастаз и с учетом трудностей такой диагностики — речь идет о весьма существенно вкладе в борьбу с детским раком. И такие препараты на основе метайодбензилгуанидина уже начали поставлять в российские больницы «Радиевый институт им. В.Г. Хлопина» и АО «В/О «Изотоп».
Стоит напомнить, что есть препараты с еще меньшей “дальностью” излучения – например, актиний-225, не так давно прошедший продвинутые клинические испытания. Это альфа-излучатель — то есть при распаде он выбрасывает не гамма-фотоны или бета-частицы, а лишь альфа-частицы. Его масса в сравнении с бета-частицами (не говоря уже о гамма-фотонах) огромна, а значит, свободный пробег в теле человека очень низок. На этом коротком отрезке он рассеивает свою довольно значительную энергию – и может повредить опухоли, “не достав”, в силу ограниченного пробега, до здоровых тканей.
Половина всего актиния-225 в РФЛП распадается за 10 дней. Иными словами, вскоре после гибели опухолевых клеток он просто исчезнет, и не окажет воздействия на остальные, здоровые ткани. Неудивительно, что в Физико-энергетическом институте интенсивно работают над наращиванием производства актиния. Недавно здесь были достигнуты большие результаты – за счет обновления схемы выделения актиния в генераторной системе торий-229/актиний-225 специалисты существенно увеличили объемы его наработки.
Такие альфа-эмиттеры, которые могут быть адресно доставлены в ядро опухолевых клеток, как актиний-225 или радий-223, относятся к крайне перспективным во всем мире.

Кстати, отечественный радиофармпрепарат на основе радия-223, созданный совместно специалистами Научно-исследовательского института атомных реакторов (АО «ГНЦ НИИАР») и Федерального научно-клинического центра медицинской радиологии и онкологии ФМБА России (ФНКЦРиО), во время клинических исследований продемонстрировал безопасность и эффективность при лечении костных метастаз рака предстательной железы. После завершения всех исследований он позволит импортозаместить иностранный оригинальный препарат, которому не уступает в качестве при более низкой цене, и обеспечить независимость российских учреждений здравоохранения от зарубежных поставок.
Объединяя разных игроков
Одну из ключевых ролей в поддержке новых высокотехнологичных проектов в области ядерной медицины играет сотрудничество между собой организаций с разной ведомственной принадлежностью — медицинских центров, вузов, НИЦ «Курчатовский институт», институтов Российской академии наук и других. Причем важно понимать: в таких коллаборациях с внешними игроками речь часто идет не только о терапии рака, но и о принципиально новых областях, в которых ядерная медицина только недавно стала играть заметную роль.
Скажем, Курчатовский институт разрабатывает радиофармпрепарат для лечения аутоиммунных артритов — заболеваний, возникающих при атаке иммунными клетками собственных тканей в суставах человека. Это тяжелое заболевание, практически не подлежащее эффективному лечению имеющимися средствами. Особенность лечения радиофармпрепаратами в том, что они позволяют с высокой точностью уничтожить клетки, поддерживающие состояние аутоиммунной атаки, и тем самым не частично смягчить симптомы, как врачи делают с такими болезнями сегодня, а вылечить острое состояние.
Другой пример плодотворного сотрудничества игроков из разных отраслей — коллаборация с химфаком МГУ в создании радиофармпрепаратов для лечения рака мочевого пузыря. Томский политехнический университет привлекают к разработкам доставки нужных изотопов с помощью молекулярных скаффолдов — особых биоматериалов, служащих своего рода «решетками», которые после имплантации могут заселять клетки самого организма человека, со временем превращая скаффолд в обычную здоровую ткань (и попутно поглощая из него те вещества, которые врачи хотели доставить в организм пациента).
Стоит отметить, что даже в тех случаях, когда речь идет о терапии рака, ядерная медицина тоже не стоит на месте. Часто она работает не только по принципу — «новый изотоп=новая возможность», но и изменяя способ доставки его к «цели».
В этом смысле показательна разработка с участием с МГУ, которую мы упомянули выше. Ключевой мишенью терапии в раковой опухоли являются не просто раковые клетки, а именно их ДНК — без ее разрушения даже серьезно поврежденные клетки могут выжить и делиться далее. Но ДНК в клетке находится в клеточном ядре, куда обычные «транспортные» соединения практически не проникают. Поэтому приходится доставлять большой объем радионуклидов в опухолевую ткань, чтобы поразить ДНК «грубой силой».
Уникальность разработки, предложенной специалистами Московского университета, в том, что их средство доставки (в настоящий момент технология на стадии патентования) способно достичь клеточного ядра. Это позволяет радикально снизить дозу облучения, получаемого организмом при таком лечении, и, при этом, поднять его эффективность.
Другой пример «роста адресности» ядерной медицины — разработка Томского политехнического университета, в которой используются особенности раковых клеток, ставшие ясными для науки не так давно. Например, у опухолевых клеток на поверхности происходит гиперэкспрессия определенных клеточных рецепторов. Иными словами, их у нее куда больше, чем у клетки обычной, здоровой ткани. Разработка томского политеха опирается на антитела, специфичные именно к этим рецепторам. За счет нее введенный в район опухоли фармпрепарат, доставляемый такими антителами, в значительных количествах дойдет только для клеток с гиперэкспрессией, и почти не затронет тех, у которых ее нет.
А что с производством?
В 2023 году в нашей стране начато строительство крупнейшего в Европе завода по производству радиофармпрепаратов в Обнинске. Он будет выпускать более широкую линейку продукции, чем любое существующее в России производство такого рода.
Это не только широко востребованные изотопы типа йода-131, самария-153, молибдена-99, но и особо перспективные активные радиофармацевтические субстанции и лекарственные препараты — на базе лютеция-177, актиния-225, радия-223 и торий с фосфоновыми кислотами, галлий-67 (для однофотонной эмиссионной компьютерной томографии), иридий, стронций. А также непростые в производстве и разделении, но потенциально крайне эффективные радиоактивные изотопы висмута-212 и свинца. Всего же на новом предприятии будет работать 21 производственная линия.
Особенность нового завода будет в том, что он объединит в одном месте и получение изотопов, и выпуск «оболочки» — радиофармпрепаратов, включающих эти изотопы. Это позволит с самого начала исключить проблему «есть изотопы — нет фармпрепаратов». Новые препараты будут использоваться для лечения пациентов, у которых диагностированы нейроэндокринные опухоли, миелоидные заболевания, рак предстательной железы, почек, костных тканей и многих других.
Не только лекарства
Но ядерная и высокотехнологичная медицина — это не только изотопы и радиофармацевтические препараты, которые их доставляют. Важнейшую роль играет и оборудование, которое осуществляет лучевую терапию.
С 2017 НИИТФА делает установку «Оникс». Система может не только диагностировать, но и лечить – используя гамма-фотоны до 6,0 МэВ, то есть намного больше, чем у кобальта-60. Чтобы получить их, используется тормозное излучение, возникающее когда электрон тормозится в электромагнитном поле аппарата. То есть перед нами система лучевой терапии, практически не нуждающаяся в обычном радионуклиде – и при этом весьма эффективная. В чем это проявляется? КЛТ-6 нужно меньше сеансов лечения, чем обычному аппарату – ведь энергия фотонов выше. При этом система из 120 подвижных вольфрамовых пластин не дает пучку излучения отклониться в сторону, и повредить здоровые ткани.

В конце прошлого года в российские больницы впервые поступил отечественный гамма-терапевтический контактный комплекс «Брахиум». Он способен гибко и прицельно облучать гамма-фотонами органы малого таза, молочной железы, пищевода, носоглотки и полости рта. Его источник гамма-излучения на короткое время подводят непосредственно к области опухоли. Он может лечить онкобольных и сам по себе, и совместно с дистанционной лучевой терапией, химиотерапией и хирургическими методами. Каждый такой комплекс может предоставить лечение сотне пациентов в год.
В НИИ НПО «Луч» создан экспериментальный образец аппарата для близкофокусной терапии онкологических заболеваний. Оборудование работает на базе миниатюрных источников рентгеновского излучения и является опциональным дополнением к широко применяемой изотопной брахитерапии (метод контактной лучевой терапии).
Кроме того, ученые-атомщики разработали компактный нейтронный генератор НГ-24, который используется в новом комплексе для проведения дистанционной лучевой терапии нейтронами с энергией 14 МэВ. Терапия нейтронами позволяет свести к минимуму облучение здоровых тканей и преодолеть устойчивость опухолевых клеток. Она более эффективна для лечения рака молочной и предстательной железы, меланомы, саркомы, рака верхушки легкого.
Флэш-терапия
Обычное излучение дает терапевтическую дозу, положенную пациенту в сутки — несколько минут облучения. Причины, по которым есть такие ограничения, интуитивно понятны: чем выше скорость получения дозы гамма-излучения, тем, по логике, выше вред здоровью пациента. Однако в последние годы удалось надежно зафиксировать необычный феномен: если резко поднять скорость получения дозы (до долей секунды), «уложив» суточную терапевтическую дозу в ничтожно короткое время, то реакция здоровых клеток окажется намного слабее, чем при облучении длиной в минуты.
Причины, по которым это происходит — пока загадка. Похоже, какие-то еще не ясные механизмы позволяют здоровым клеткам, получившим такую «флэш-терапию», запустить систему защиты и/или восстановления ДНК, которые не срабатывают при традиционном, длительном облучении.
При этом раковые клетки, судя по всему, таких систем защиты не имеют. При быстром получении дозы облучения они гибнут с такой же частотой, как и при обычной терапии. Такая ситуация создает новое «окно возможностей». Потенциально можно вести речь о некотором увеличении суточной терапевтической дозы без вреда для пациента.
Подведем итоги. Ядерная и высокотехнологичная медицина — не просто «одна из» наиболее активно развивающихся отраслей медицины, но и отрасль исключительно важная.
Биологи получили прямые доказательства поедания косатками представителей собственного вида. Оторванные спинные плавники со следами больших зубов указали на охоту плотоядных китообразных на слабую соседнюю популяцию. Угроза смертельных нападений заставила рыбоядные группы косаток создавать неразлучные семейные кланы.
Исследователи смоделировали последствия распыления в марсианской атмосфере аэрозолей для создания искусственного парникового эффекта. Выяснилось, что это может привести к парадоксальному результату: вместо ожидаемого более комфортного климата будущая колония на «нагретой» Красной планете окажется посреди такого же лютого холода и притом окружена обезвоженным грунтом.
В ноябре 2025 года при взлете российской ракеты с Байконура к МКС с существенной высоты упала кабина обслуживания 8У216. Поскольку в 2010-х годах из экономии средств у нас отказались от дублирования стартовых площадок, это создало ситуацию временной невозможности пилотируемых полетов. Теперь, всего через три месяца после происшествия, «Роскосмос» смог решить проблему, поставив запасную кабину обслуживания, найденную на складах Минобороны. Весенние пуски к МКС, запланированные ранее, теперь имеют шансы пройти в срок.
В ноябре 2025 года при взлете российской ракеты с Байконура к МКС с существенной высоты упала кабина обслуживания 8У216. Поскольку в 2010-х годах из экономии средств у нас отказались от дублирования стартовых площадок, это создало ситуацию временной невозможности пилотируемых полетов. Теперь, всего через три месяца после происшествия, «Роскосмос» смог решить проблему, поставив запасную кабину обслуживания, найденную на складах Минобороны. Весенние пуски к МКС, запланированные ранее, теперь имеют шансы пройти в срок.
В той части Пиренеев, которые находятся на территории Испании, исследователи обнаружили первые доказательства добычи золота в эпоху Римской империи. На месте древних рудников нашли сложные гидравлические сооружения и остатки водохранилища, возраст которых определили с помощью метода оптического датирования. Открытие прольет свет на инженерные приемы римлян и поставит точку в многолетнем споре: действительно ли римляне добывали золото в этом регионе.
Разное отношение домашних животных к хозяевам давно стало предметом споров, обсуждений и шуток. Ученые из Венгрии показали, что собаки демонстрируют по отношению к человеку уровень альтруизма, сходный с детским, тогда как кошки ищут в партнерстве с человеком прежде всего свою выгоду.
Астрономы недавно проанализировали базу данных о падающих на Землю объектах и пришли к выводу, что два из них прибыли из межзвездного пространства. Известна не только дата, но и место падения каждого из них.
«Любить лишь можно только раз», — писал поэт Сергей Есенин, а герои культовых сериалов приходили к выводу, что «настоящая» влюбленность случается в жизни максимум дважды. Однако ни один из этих тезисов не подкреплен научными данными. Американские исследователи подошли к вопросу иначе: опросили более 10 тысяч человек и вывели среднее число сильных влюбленностей, возможных в течение жизни.
В ноябре 2025 года при взлете российской ракеты с Байконура к МКС с существенной высоты упала кабина обслуживания 8У216. Поскольку в 2010-х годах из экономии средств у нас отказались от дублирования стартовых площадок, это создало ситуацию временной невозможности пилотируемых полетов. Теперь, всего через три месяца после происшествия, «Роскосмос» смог решить проблему, поставив запасную кабину обслуживания, найденную на складах Минобороны. Весенние пуски к МКС, запланированные ранее, теперь имеют шансы пройти в срок.

Вы попытались написать запрещенную фразу или вас забанили за частые нарушения.
Понятно
Из-за нарушений правил сайта на ваш аккаунт были наложены ограничения. Если это ошибка, напишите нам.
Понятно
Наши фильтры обнаружили в ваших действиях признаки накрутки. Отдохните немного и вернитесь к нам позже.
Понятно
Мы скоро изучим заявку и свяжемся с Вами по указанной почте в случае положительного исхода. Спасибо за интерес к проекту.
Понятно







