Российские ученые создали интерактивную карту резистентности (устойчивости) микробиоты кишечника к антибиотикам. ResistoMap «мыслит» в мировом масштабе, так что с ее помощью можно выявить особенности употребления антибиотиков для каждой отдельной страны
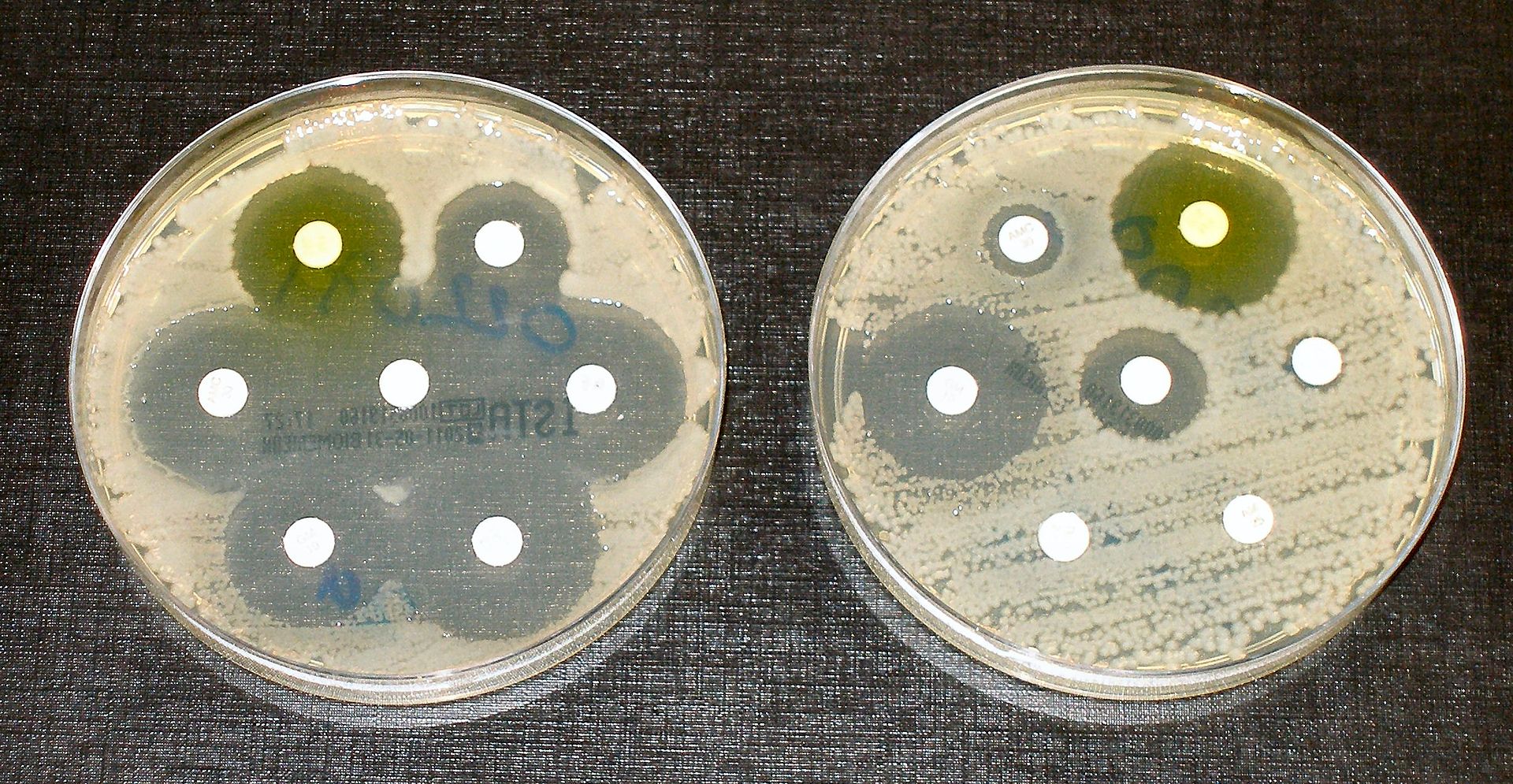
Тесты на устойчивость к антибиотикам: Бактерии высевают штрихами на чашках с белыми дисками, пропитанными антибиотиком. Чистые кольца, как на чашке слева, показывают, что бактерии не выросли — что свидетельствует об отсутствии устойчивости у этих бактерий. Бактерии на чашке справа полностью восприимчивы только к трем из семи протестированных антибиотиков / Википедия
Напомним, что в 2014 году Всемирная организация здравоохранения (ВОЗ) впервые обозначила проблему устойчивости к антибиотикам как серьезную опасность для здоровья людей. «В связи с отсутствием оперативных и согласованных действий наш мир вступает в эпоху, когда антибиотики теряют эффективность и обычные инфекции и небольшие травмы, которые можно было излечивать в течение многих десятилетий, сейчас начинают снова убивать», – заявил тогда помощник генерального директора ВОЗ по безопасности здравоохранения Кейджи Фукуда. Микробная лекарственная устойчивость вызвана повсеместным неконтролируемым использованием антибиотиков в медицине и сельском хозяйстве. Эксперты утверждают, что к 2050 году это приведет к тому, что смертность составит примерно 10 млн человек ежегодно.
Российские ученые из Федерального научно-клинического центра физико-химической медицины, Московского физико-технического института и Лаборатории данных создали ResistoMap – интерактивную визуализацию кишечного резистома (от лат. resisto – сопротивляюсь) – присутствия генов лекарственной устойчивости к действию антибиотиков в микробиоте кишечника человека. Навигация карты позволяет сформулировать гипотезы относительно глобальных тенденций устойчивости к антибиотикам и сопоставить особенности резистома кишечника с национальными практиками по применению лекарств.
Микробиота (микробиом, микрофлора) – это совокупность всех микроорганизмов в теле человека. Из всех органов, тканей и сред организма микрофлора кишечника является доминирующей по численности и крайне важной для его жизнеобеспечения. Оставаясь невидимым, этот «орган» весит около двух килограммов и насчитывает порядка десяти триллионов клеток микроорганизмов.
По данным молекулярно-генетических исследований, видовой состав микрофлоры стабилен во времени, но способен сильно меняться при резком изменении диеты или приеме антибиотиков. Кишечное сообщество представляет собой сложную экосистему из сотен видов, в геномах которых закодировано на два порядка больше генетической информации, чем в геноме человека. Совокупность этих геномов – метагеном – содержит в том числе «поведенческий код» для членов сообщества, определяющий их пищевые и другие связи между собой и внешним миром. Правильный обмен веществ, здоровые сосуды, нормальное пищеварение, устойчивость к внешним инфекциям (состояние иммунитета) человека во многом определяется стабильностью и «здоровьем» его микрофлоры.
Пул генов (генофонд) антибиотикорезистентности (гены, ответственные за устойчивость бактерий к действию препарата), уровень которого увеличивается во время лечения антибиотиками, потенциально является «коромыслом» в передаче этих генов патогену и имеет серьезные последствия как для отдельного человека, так и для общества в целом. Анализ функционального состава микробиоты с использованием метагеномики позволяет оценить распространенность генов устойчивости в микробиоте человека и, таким образом, в перспективе обеспечить индивидуальный прогноз для способности микробиоты человека внести вклад в устойчивость патогенов. К настоящему моменту опубликованы обширные объемы метагеномных данных по микробиоте кишечника, которые дают возможность оценить разброс структуры резистома у здорового населения стран мира, а также у пациентов с различными заболеваниями.
ResistoMap содержит два основных интерактивных рабочих поля: географическую и тепловую карты. Пользователь может выбрать интересующую группу антибиотиков или страну и получить срез резистома. Таким образом, данные могут быть отфильтрованы по странам, полу, возрасту и диагнозу. В настоящий момент по фактору уровня резистома проанализированы данные для более чем 1600 человек, охватывающие 15 стран. При этом для пользователей ресурса имеется возможность добавления на карту резистома новых опубликованных данных в едином формате.
Используя ResistoMap, можно оценить глобальное изменение потенциала резистентности к различным группам антибиотиков и изучить связи между специфическими лекарственными средствами и клиническими факторами. Например, метагеномы датчан, как правило, демонстрируют самый низкий уровень резистома среди европейских групп, тогда как французские образцы имеют самые высокие уровни, особенно фторхинолонов (антибактериальных лекарственных средств широкого спектра действия).
Это согласуется с тем фактом, что Франция имеет самый высокий уровень использования антибиотиков в Западной Европе, а в Дании и Германии применение противомикробных препаратов распространено значительно меньше – как в здравоохранении, так и в сельском хозяйстве. С другой стороны, китайское и русское население имеет более высокий уровень резистома – вероятно, ввиду менее жестких правил применения антибиотиков, частого назначения антибиотиков широкого спектра, а также легкой доступности этих препаратов (многие из них можно получить без рецепта врача). Самые низкие уровни резистентности микробиоты наблюдаются у изолированной популяции индейцев Венесуэлы, практически не имеющих контактов с населением развитых стран. Анализ выявляет некоторые новые тенденции, которые ожидают дальнейшего толкования с клинической точки зрения.
Разработчики уверены, что ResistoMap поможет не только в анализе данных по устойчивости микроорганизмов к антибиотикам, но и в конечном итоге поспособствует разрешению проблемы. «Мы предполагаем, что разведочный анализ глобального ландшафта антимикробной устойчивости кишечной микробиоты с использованием ResistoMap подскажет исследователям новые идеи о том, как оптимизировать схемы применения антибиотиков в медицине, а также в сельском хозяйстве», – заявил один из авторов разработки Константин Ярыгин.