Новый подход может стать надеждой для сотен тысяч человек, страдающих неизлечимым на сегодня нейродегенеративным заболеванием.
© Nature, 2019
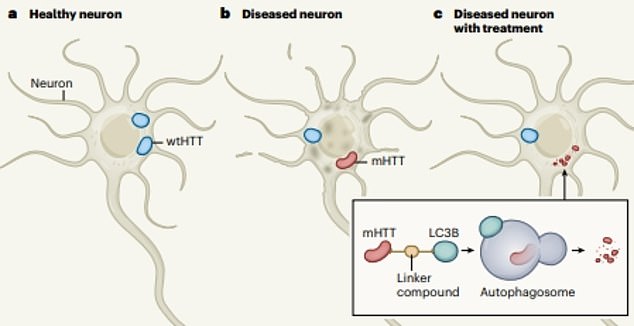
Исследователи из Фуданьского университета в Китае протестировали на животных метод, позволяющий уничтожать мутировавший белок гентингтин, не затрагивая при этом его нормальную форму. Статья о работе вышла в журнале Nature.
Авторы протестировали несколько различных соединений, которые могли бы избирательно очищать нейроны от смертельного белка. Они нашли четыре молекулы, которые в будущем могли бы помочь отыскать действующее вещество для лекарства от болезни Хантингтона у человека.
Хорея Хантингтона (или Гентингтона) — неизлечимое аутосомно-доминантное нейродегенеративное заболевание. Внешние проявления начинаются с непроизвольных неконтролируемых движений и постепенно усугубляются когнитивными нарушениями. Со временем к ним присоединяются симптомы психических расстройств, а также разные физиологические осложнения. Как правило, после постановки диагноза больные живут не более 10-20 лет, причем нередкой причиной смерти становится суицид.
Заболевание вызывает мутация белка гентингтина, который кодируется геном HTT. Ведущая функция нормальной формы гентингтина до конца не известна, однако, согласно исследованиям, он необходим для нормального функционирования нейронов. Белок участвует во многих процессах, протекающих в нервной ткани, и играет важную роль при эмбриогенезе: если его исключить, плод погибает.
В норме гентингтин из-за полиморфизма кодирующего его гена HTT имеет изменчивую структуру, содержащую от шести до 35 глутаминовых остатков. При мутации гена их количество увеличивается, доходя порой до 250. Предполагается, что из-за этого мутантный белок (mHtt) увеличивает свою токсичность и, накапливаясь в нейронах, со временем приводит к хорее.
Основная проблема лечения сегодня связана с тем, что не существует способа уничтожить мутировавший белок, не затрагивая жизненно важный нормальный гентингтин. Работа китайских ученых дает надежду, что такая возможность все же есть.
Наилучшие результаты при тестировании на генномодифицированных мухах и мышах показали молекулы 10O5, 8F20, AN1 и AN2. Доктор Боксун Лу и другие авторы работы отмечают, что это только начало пути, однако дальнейшие исследования выглядят перспективными. Правда, кроме поиска пути наибольшей эффективности будущих препаратов, предстоит провести и тестирования на предмет рисков. Например, как отмечает доктор Худа Зогби из Медицинского колледжа Бейлора в Хьюстоне, не принимавшая участия в исследовании, нужно убедиться, что соединения непреднамеренно не вычищают другие жизненно важные белки и не могут ли они тоже стать токсичными с годами, по мере накопления.
До клинических испытаний еще далеко, однако, возможно, именно этот метод станет надеждой для больных. «К сожалению, до сих пор ничто из того, что не работало в мышиной модели, не замедляло заболевание у пациентов. Поэтому важно тщательно изучить эти новые препараты, чтобы получить наилучшее представление о том, является ли этот подход безопасным и достаточно эффективным, чтобы его можно было перенести на испытания на людях», — говорит доктор Эдвард Уайлд из Центра болезни Хантингтона Университетского колледжа Лондона.
Ранее ученые выяснили, что белок, тормозящий активность мозга, продлевает жизнь, а также нашли эффективное средство против гриппа.