Нарушения метаболизма холестерина связаны с развитием целого ряда болезней — не только сердечно-сосудистой системы, но и, скажем, затрагивающих головной мозг. Обмен холестерина в этом органе устроен очень сложно, но особенно важным считают выведение этого вещества из нейронов. Его осуществляет фермент-цитохром P450 46A1 — один из множества цитохромов, который работает именно в нервной системе.
Этот фермент также называют холестерин-24S-гидроксилазой, или CYP46A1. Он катализирует превращение холестерина в 24S-гидроксихолестерин и тем самым способствует его удалению.
Медикам и ученым важно знать, настолько интенсивно мозг избавляется от холестерина и как на это влияют различные внешние факторы. Однако ранее методов визуализации концентрации этого важного метаболита в мозге они не имели.
Пробел восполнили авторы новой статьи в Science Translational Medicine, большая международная команда исследователей. Они создали и успешно испытали новую молекулярную метку, которая специфически связывает CYP46A1 и подходит для визуализации активности этого фермента с помощью позитронно-эмиссионной томографии (ПЭТ).
Метка получила название 18F-Холестифай (18F-Cholestify, 18F-CHL-2205). Это небольшая молекула содержит легко отслеживаемый радиоизотоп фтор-18 — она прочно и избирательно связывается с активным центром цитохрома CYP46A1.
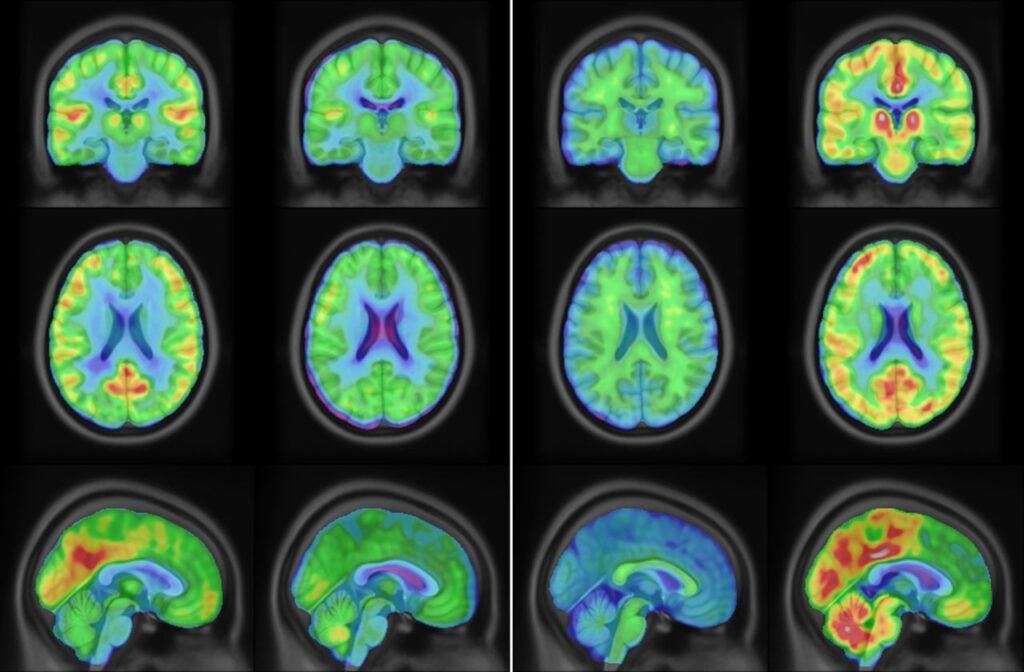
С помощью радиоактивного сигнала от фтора-18 (используя метод авторадиографии) и вестерн-блоттинга исследователи установили: после введения 18F-Холестифай хорошо проникает в мозг мышей, крыс и макак-резусов. Метка особенно активно накапливается в коре больших полушарий, гиппокампе и таких анатомических структурах мозга, как скорлупа и хвостатое ядро.
В то же время в мозге мышей с нокаутированным (то есть «выключенным») геном цитохрома CYP46A1 или после химического ингибирования фермента 18F-Холестифай почти не задерживался.
Авторы исследования также испытали новую метку на людях. Четырем мужчинам и четырем женщинам в возрасте 22-31 года ввели 18F-Холестифай и сделали им ПЭТ головного мозга. Молекула-метка хорошо накапливалась в коре больших полушарий, таламусе и базальных ганглиях — тех частях мозга, где цитохром CYP46A1 экспрессируется особенно сильно.
Известно, что у людей с умеренными когнитивными нарушениями (которые могут сигнализировать о начале заболевания, в том числе болезни Альцгеймера) в спинномозговой жидкости повышается уровень метаболита холестерина — 24-гидроксихолестерина, а также особой патологической формы тау-белка (p-tau181).
Новая методика позволит эффективно визуализировать первые признаки приближающейся болезни непосредственно в мозге, задолго до появления первых симптомов и с хорошей детализацией.
«Раньше мы могли только отметить активность CYP46A1, померив концентрацию 24-гидроксихолестерина в спинномозговой жидкости; теперь новый лиганд (молекула со специфическим связыванием. — Прим. ред.) позволит исследователям получать карту его пространственного распространения в мозге», — рассказал Микаэл Симонс (Mikael Simons) из Технического университета Мюнхена (Германия).
Ученый полагает, что высокая скорость метаболизма холестерина у трансгенных мышей, служащих моделью болезни Альцгеймера (животные линии 3xTg), может быть связана с нейродегенеративным процессом в их мозге. Происходящая при этом гибель нейронов приводит к разрушению клеточных мембран, которые, как известно, содержат большое количество холестерина. Тот попадает наружу, и цитохрому CYP46A1 приходится активнее от него избавляться.
Исследователи также отметили любопытные половые различия в распределении 18F-Холестифай. Оказывается, в скорлупе и хвостатом ядре женского мозга метка накапливалась быстрее — по-видимому, это связано с большей скоростью метаболизма холестерина в норме.