Статья с подробным описанием этого открытия опубликована в журнале Nature. CrAss-подобные фаги – аналоги открытого недавно бактериофага crAssphage, который получил свое название от метода сборки генома (cross-assembly). Ученые обнаружили этот вирус, проводя исследование имеющихся в открытом доступе данных о метагеноме фекалий человека (метагеном представляет собой совокупность информации о генетически последовательностях всех микроорганизмов, присутствующих в образце).
Удивителен тот факт, что вирус crAssphage, обнаруженный только в 2014 году, оказался самым распространенным фагом в кишечной микрофлоре человека. Позднее ученые, в том числе соавтор этой статьи Евгений Кунин и его коллеги, обнаружили и других представителей этого класса вирусов, которые ранее никогда не исследовались в лабораторных условиях.
«Поскольку crAss-подобные фаги – самые распространенные вирусы в кишечнике человека, понимание механизма инфицирования хозяйских клеток этими фагами позволит контролировать состав микробиома, что, в свою очередь, важно для охраны здоровья человека и борьбы с различными заболеваниями. Наш интерес к изучению crAss-подобных фагов обусловлен еще и тем, что эти вирусы транскрибируют свои гены, используя необычные РНК-полимеразы (то есть ферменты, формирующие РНК на основе шаблона ДНК)», − отмечает старший преподаватель Центра наук о жизни Сколтеха (CLS) Мария Соколова.
Соколова и ее коллеги использовали crAss-подобный фаг phi14:2, который инфицирует бактерии Cellulophaga baltica, широко распространенные на побережьях. Оказалось, что этот вирус удобно использовать в качестве модели для лабораторных исследований. В частности, ученые исследовали предсказанную РНК-полимеразу этого вируса — gp66, представляющую собой достаточно крупный белок, функция которого ранее была неизвестна.
Анализируя аминокислотную последовательность gp66, исследователи обнаружили в ней небольшой фрагмент, напоминающий фрагмент клеточной мультисубъединичной РНК-полимеразы. Исследователи выделили белок gp66 и продемонстрировали in vitro, что он выполняет функцию РНК-полимеразы.
«Стандартный тест на активность РНК-полимеразы, который обычно дает положительный результат для всех других РНК-полимераз, показал, что предсказанная РНК-полимераза crAss-подобного фага является неактивной. Зная о наличии необычных свойств у ферментов вирусов, мы продолжили тесты в поиске активности и в итоге нашли ее. Мы были очень довольны полученным результатом, поскольку до этого момента мы сомневались в достоверности предсказаний с помощью методов биоинформатики, в которых сходство gp66 с известными ферментами оказывалось минимальным», − рассказывает Соколова.
В экспериментах in vitro было показано, что антибиотик рифампицин блокирует собственную РНК-полимеразу бактерии C. baltica, но не оказывает никакого воздействия на gp66. Исследователи проверили, какие гены phi14:2 в итоге транскрибируются в инфицированных клетках в присутствии рифампицина и обнаружили множество так называемых ранних генов, которые кодируют механизмы, необходимые вирусу для захвата хозяйской клетки на ранних стадиях инфекции.
При этом средние и поздние гены, проявляющие активность на более поздних стадиях инфекции, присутствовали в меньших количествах. Это говорит о том, что вирус phi14:2 обладает своей собственной РНК-полимеразой; белок gp66 он использует на ранней стадии инфекции, прежде чем сам сможет воспользоваться полимеразой хозяйской клетки.
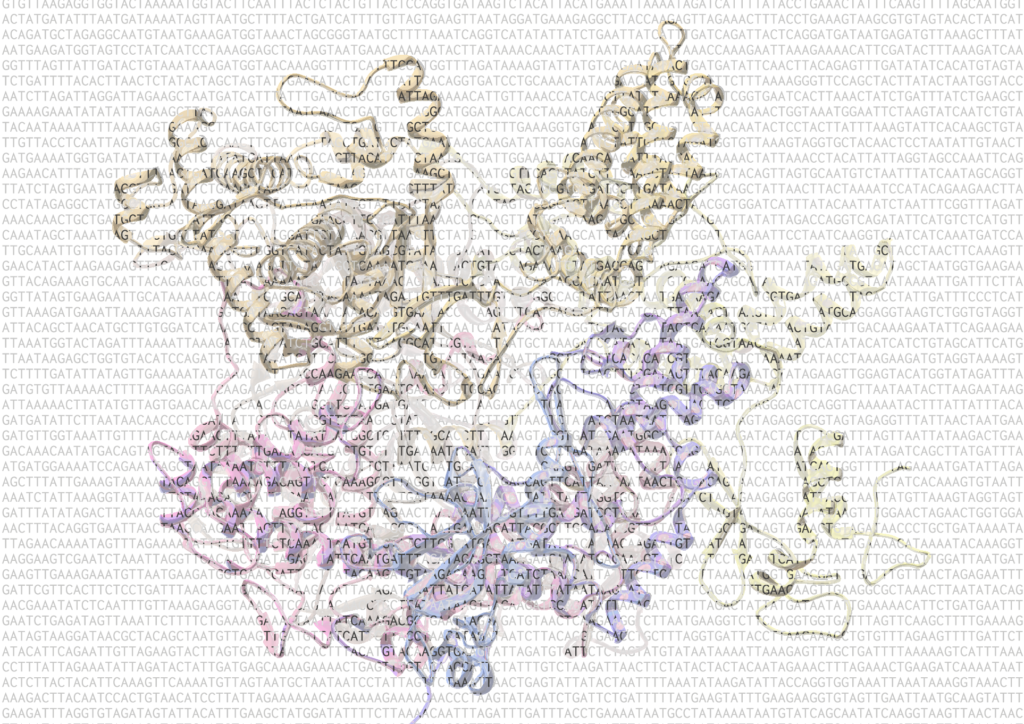
Ученые не только смогли определить кристаллическую структуру белка gp66, но и обнаружили, что большинство его структурных элементов не имеет известных аналогов, а их функции неизвестны. Однако было установлено сходство центральной части gp66 с РНК-полимеразой, которая у высших организмов участвует в процессе РНК-интерференции, что позволяет подавлять функцию некоторых генов.
По словам соавтора статьи Константина Северинова, «это потрясающий результат, позволяющий предположить, что источником ферментов РНК-интерференции − процесса, который считался характерным лишь для клеток высших организмов (эукариот), является фаг. Другими словами, эти ферменты были «заимствованы» у бактериального вируса − предка современных crAss-подобных фагов на ранних этапах эволюции.
Это открытие показывает, что эволюция высших клеток представляла собой сложный процесс, в ходе которого происходили многократные приобретения предковыми клетками ферментов бактерий и даже фагов. Еще один классический пример этого процесса − приобретение целых бактерий предковой эукариотической клеткой, которая впоследствии стала митохондрией».
Исследователи также установили, что в кристаллической структуре gp66 каталитически активный центр находится в конформации, которая ранее никогда не наблюдалось ни в одной РНК-полимеразе. Ученые предположили, что до упаковки в фаговую частицу gp66 находится в выключенном состоянии. «Данный фермент обладает свойствами, характерными для белков, образующих оболочки вирусов (например, гемагглютинина, гликопротеинов флави- и альфавирусов). Эти белки проходят этап созревания во время сборки вирусных частиц, необходимый для обеспечения их активности.
У РНК-полимеразы сrAss-подобного фага созревание, возможно, тоже происходит при встраивании в частицу вируса или транслокации через хвост фага в клетку при инфекции», − отмечает один из авторов статьи, исследователь Центра структурной биологии и молекулярной биофизики Сили при Медицинском отделении Техасского университета Петр Лейман.
Мария Соколова подчеркивает, что это первое исследование, в котором функция crAss-подобных вирусов была рассмотрена на молекулярном и атомном уровнях. «Наша работа открывает перспективы для регулирования механизмов инфекции crAss-подобными фагами, что, в свою очередь, может стать основой для разработки новых подходов к управлению составом микробиома кишечника человека», − добавляет она.
Исследование проводилось с участием специалистов Института молекулярной генетики РАН, Института микробиологии Ваксмана при Ратгерском университете − Государственном исследовательском университете штата Нью-Джерси (США), Санкт-Петербургского политехнического университета Петра Великого, Школы остеопатической медицины при Университете Роуэн (США), Университета Линнеус (Швеция), Национального центра биотехнологической информации (США) и Медицинского отделения Техасского университета (США).