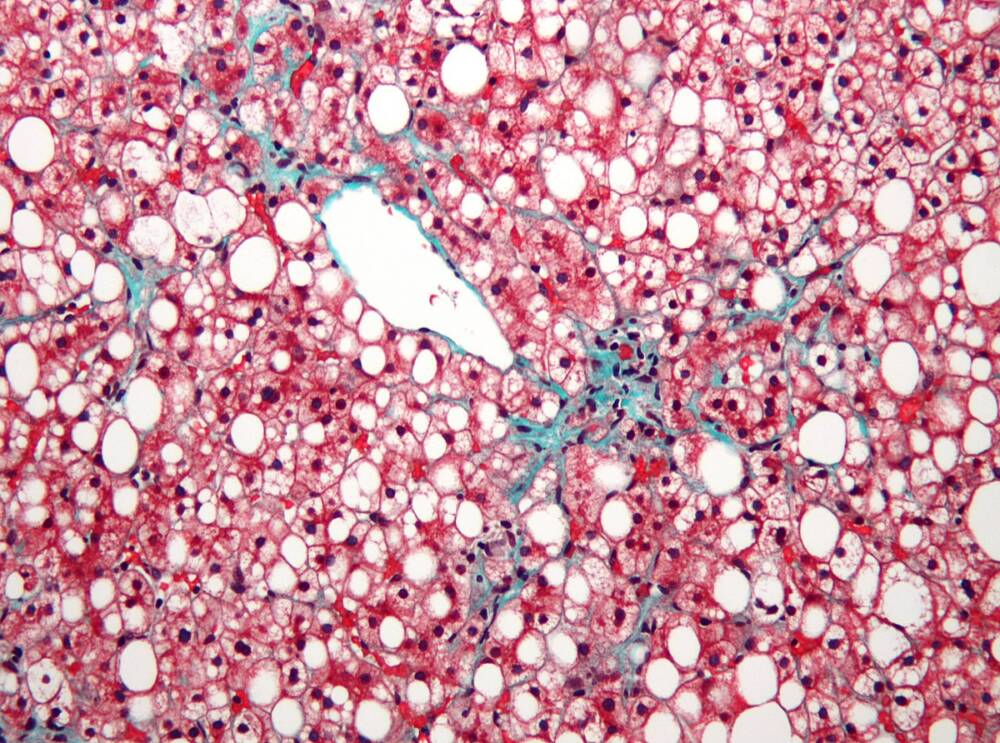
Исследователи из Массачусетской больницы общего профиля нашли, как связаны друг с другом дисбаланс электронов в тканях печени и некоторые дисфункции метаболизма, в частности, те, что повышают риск заболеваний сердца и сосудов, а также жировой болезни печени. Авторы работы описывают, каким образом явление, известное как редуктивный стресс, приводит к таким последствиям и как это связано с генетическими факторами и внешним влиянием окружающей среды, например с диетой. Статья опубликована в журнале Nature.
Редуктивный стресс случается, когда в клетках собирается избыточное число электронов. «Пища, которую мы едим, имеет тенденцию быть очень богатой электронами», — говорит старший автор работы доктор Вамси Моота. Все это происходит, если возникает дисбаланс между «спросом и предложением», то есть организм тратит меньше отрицательно заряженных частиц, чем получает.
Диета, в которой преобладает пища с высоким содержанием жиров и регулярное употребление алкоголя, может приводить к этому явлению в клетках печени. Хотя более ранние работы обнаруживали связь редуктивного стресса с определенными редкими митохондриальными генетическими заболеваниями, исследователи не знали, как именно он участвует в распространенных болезнях и нарушениях.
Ученые создали генно-инженерный фермент печени LbNOX. Его протестировали на модельных животных (мышах), которых поили алкоголем. «Алкоголь генерирует массу свободных электронов, что вызывает высокий уровень стресса», — говорит ведущий автор работы доктор Рассел Гудман. Как оказалось, LbNOX остановил у мышей развертывание редуктивного стресса: с помощью этого генетического инструмента можно контролировать это состояние в клетках печени.
Авторы выявили в крови подопытных мышей метаболит альфа-гидроксибутират: его уровень рос, если электроны накапливались в тканях печени. Ученые обратили на это внимание, так как накопление альфа-гидроксибутирата в крови, в свою очередь, связано с такими нарушениями метаболизма, как инсулинорезистентность и ожирение.
Ранее генетический анализ показал, что у людей существует связь между «привычно высоким» уровнем альфа-гидроксибутирата и наличием генетического варианта гена GCKR. Он обнаруживается у 50% людей и, судя по всему, связан с повышенной вероятностью многих метаболических болезней, например стеатозом печени и высоким содержанием в кровотоке триглицеридов — «плохих» жиров.
Оказалось, у модельных животных мутация GCKR также связана с высоким уровнем альфа-гидроксибутирата и одновременно — с редуктивным стрессом.
Важным результатом работы стало обнаружение того, что лечение редуктивного стресса с помощью LbNOX снижает уровень триглицеридов. Их высокое содержание связано с возрастающим риском сердечно-сосудистых заболеваний и многими неприятными метаболическими факторами, включая инсулинорезистентность.
Авторы надеются, что альфа-гидроксибутират в будущем станет биомаркером, который сможет эффективно показывать редуктивный стресс, а LbNOX можно будет использовать для терапии болезней, обусловленных метаболическими проблемами. Однако требуется еще масса дополнительных исследований, чтобы выяснить, действительно ли это попадет в клиническую практику.