Больше половины всех антибиотиков, используемых для лечения бактериальных инфекций, блокируют работу рибосом, синтезирующих белки в клетках. В результате этого нарушения или даже полной блокировки бактерии перестают расти либо гибнут. Но некоторые виды патогенных микроорганизмов приспособились и выработали механизмы защиты от подобных лекарств. Такие бактерии называют антибиотикорезистентными. И проблема устойчивости патогенов сейчас стоит крайне остро.
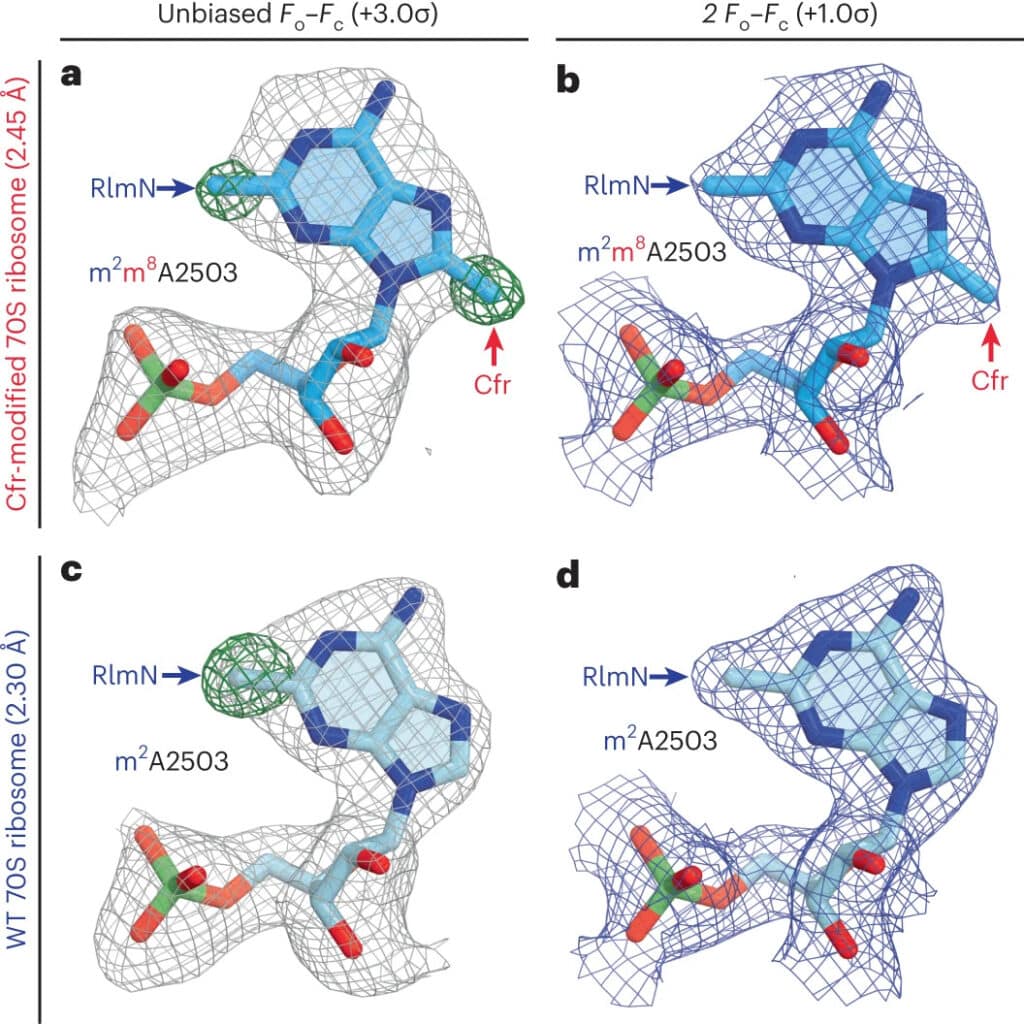
Один из подобных механизмов защиты устроен так. Ген cfr в бактериальных клетках производит специальный фермент — метилтрансферазу Cfr. Она модифицирует сайт связывания антибиотика с патогеном. Как считалось ранее, эта модификация просто блокировала сайт в рибосомах, отчего лекарство не могло соединиться с бактерией и не срабатывало. Но исследователи из Иллинойса вместе с коллегами из Гарварда (США) с помощью рентгеноструктурного анализа модифицированной рибосомы выяснили, что механизм защиты бактерий от антибиотиков метилтрансферазой Cfr гораздо сложнее. Статья об этом опубликована в журнале Nature Chemical Biology.
Чтобы понять, почему метилирование одного нуклеотида в рибосоме приводит к блокировке, исследователи определили структуру модифицированной органеллы со структурой немодифицированной. Выяснилось, что Cfr-модификация по-разному влияет на связывание антибиотиков из разных классов. Например, в случае линкозамидов и стрептограминов типа А модификация рибосомы мешает химической реакции стерически, то есть пространственно перекрывает сайт. Но в случае с фениколами и оксазолидинонами антибиотик не может связаться с рибосомой потому, что место связывания перестраивается и нуклеотиды смещаются. Такой эффект в биохимии называют аллостерическим.
Также исследователи выяснили, что некоторые антибиотики способны преодолевать этот тип бактериальной устойчивости. Для этого они определили трехмерные структуры резистентной модифицированной рибосомы вместе с недавно синтезированным антибиотиком ибоксамицином (IBX). Антибиотик был связан с метилированными рибосомами модельной грамотрицательной бактерии Thermus thermophilus. Ее устойчивость обеспечивал именно ген cfr. Теоретически IBX не должен связываться с модифицированными рибосомами, но тот факт, что антибиотик успешно подавляет рост патогенных бактерий, говорит об обратном.
Авторы исследования выяснили, что ибоксамицин связывается с бактериальной рибосомой настолько сильно, что даже метилированный нуклеотид A2503, который должен препятствовать работе антибиотика, никак не мешает. Он сдвигается в сторону, позволяя молекуле ибоксамицина соединяться с модифицированной рибосомой точно так же, как с обычной.
«Он просто связывается с рибосомами и действует так, как будто ему все равно, было это метилирование или нет. Он легко преодолевает несколько наиболее распространенных типов лекарственной устойчивости», — отметил соавтор работы Юрий Поликанов.
Как считают исследователи, важность таких открытий состоит в том, что подобное поведение нуклеотидов невозможно предсказать без трехмерных структур. А понимание двухкомпонентного механизма защиты бактерий и модель модифицированной рибосомы могут помочь в создании антибиотиков нового поколения, активных против патогенов с множественной устойчивостью.