Результаты опубликованы в журнале «Биохимия». Оптогенетические методы пополнили арсенал биологов недавно, но быстро зарекомендовали себя как мощный и высокоточный инструмент для управления клетками. Прежде всего, так называемыми возбудимыми клетками, то есть способными отвечать активными действиями на сигнал извне. Таковы нейроны, мышечные клетки, а также клетки желез.
Особенно впечатляют успехи с нейронами: их можно возбуждать или, наоборот, «выключать», картировать нейронные сети и, возможно, даже использовать оптогенетику для лечения глухоты и слепоты. Подход также годится для изучения тонких физиологических процессов в невозбудимых клетках. Например, можно исследовать их отдельные «отсеки» — органеллы и компартменты, — отслеживая изменения различных параметров среды.
Среди них показатель кислотности (pH), который важен для нормального функционирования клетки и ее частей. Его смещение в сторону меньших (закисление) или больших значений (защелачивание) связано с многими патологическими изменениями при болезнях.
Также важен показатель кислотности внутри митохондрий, в их матриксе. Эти «энергетические станции» клетки играют важную роль в ее жизни и смерти, производя в ходе работы активные формы кислорода (АФК). Они имеют важное регуляторное значение в небольших количествах, но их взрывообразное накопление летально для клетки. В норме матрикс митохондрий имеет слабощелочную реакцию (pH около 8), а ее изменения могут приводить к запуску программы программируемой клеточной гибели — апоптоза.
Отдельный важный вопрос: как кислотность внутри митохондрий влияет на генерацию ими АФК. Сейчас оба фактора активно изучают, поскольку они важны для развития ряда патологий: заболеваний сердца, диабета, нейродегенераций и рака.
Этими вопросами заинтересовались биофизики из Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ, авторы новой статьи. Они отмечают, что в клетках млекопитающих защелачивание матрикса, генерация активных форм кислорода и передача сигнала с помощью ионов кальция тесно связаны. Причем в определенных условиях эти факторы — вместе и по отдельности — способствуют появлению пор в мембранах митохондрий и, как следствие, гибели всей клетки. Образование АФК в этом случае — это ключевой этап на пути клетки к апоптозу.
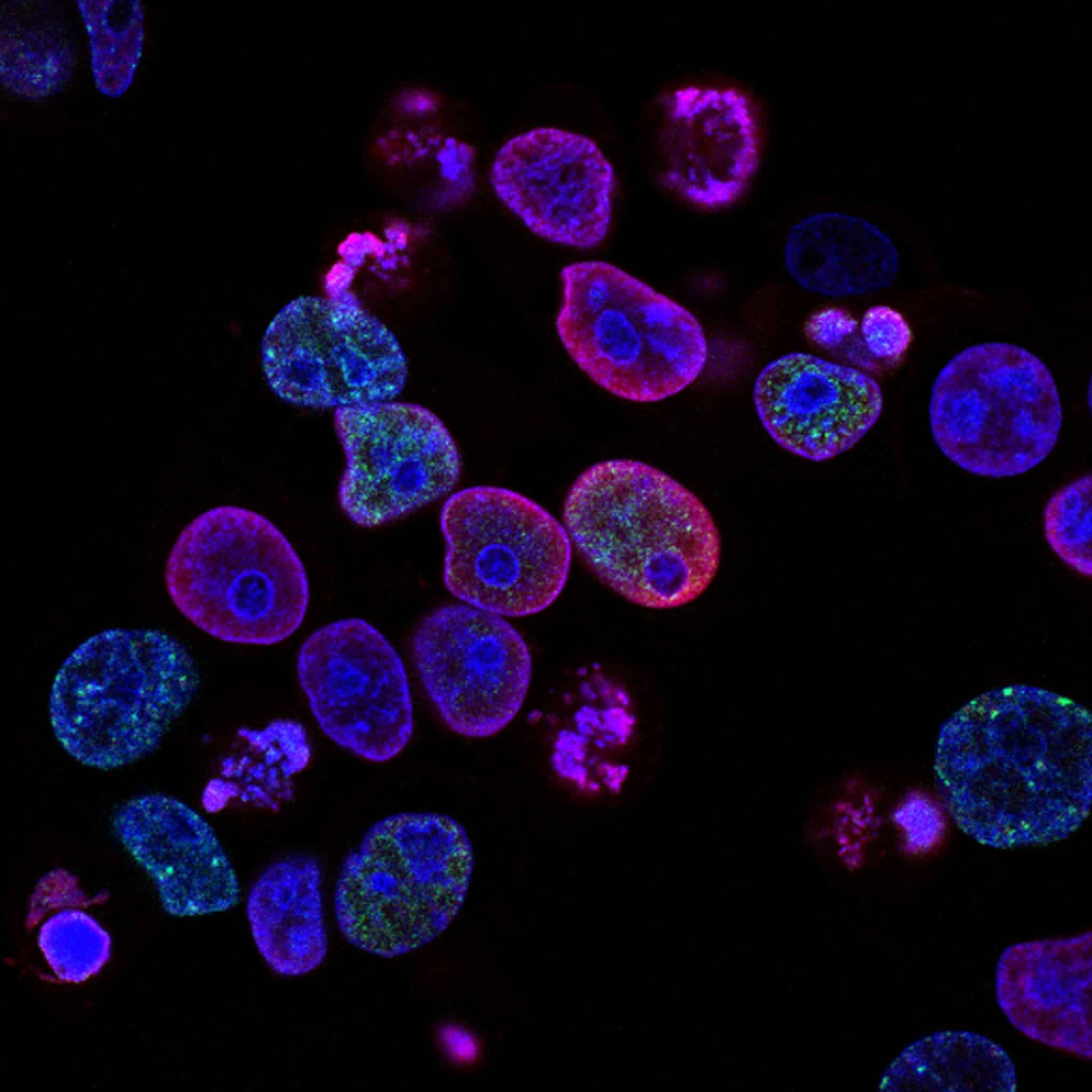
В работе ученым помогли флуоресцентные сенсоры — молекулы, которые избирательно накапливаются внутри клеток и их митохондрий. Изменяя свои спектры флуоресценции, они сигнализировали о наличии перекиси водорода H2O2. Это соединение — одно из АФК, и оценка его концентрации позволяет понять общий уровень окислительного стресса, то есть дисбаланса между активными формами кислорода и борющимися с ними антиоксидантными системами.
В работе впервые изучено образование АФК при оптогенетическом защелачивании цитоплазмы — внутренней среды клетки. Для этого использовали протонный насос Arch3 — белок из археи Halorubrum sodomense, который выкачивает катионы водорода из клетки во внешнюю среду, если подействовать на него светом определенной длины волны. В результате внутри клетки падает их концентрация, а показатель кислотности растет. Иными словами, происходит защелачивание основной среды клетки — ее цитоплазмы.
Arch3 экспрессировали на цитоплазматической мембране HeLa — культивируемых «бессмертных» клеток карциномы человека. В цитоплазме и внутри митохондрий они содержали чувствующие перекись водорода молекулы-сенсоры HyPer7. Это флуоресцентный краситель, который в исходном состоянии ярко светится после возбуждения на длине волны 405 нанометров (фиолетовый свет). Однако после взаимодействия с перекисью HyPer7 переключается в состояние, когда его более эффективно возбуждает голубой свет с длиной волны 488 нанометров.
Авторы учли соотношение интенсивностей флуоресценции для возбуждения на двух длинах волн, чтобы избежать артефактов спектральных замеров. В том числе вызванных сдвигом pH, изменениями формы клеток, их перемещением, смещением оптического фокуса и так далее. Как и следовало ожидать, оптогенетическое защелачивание вызвало резкий рост содержания перекиси водорода — одной из важнейших АФК — как в цитоплазме клеток, так и внутри митохондрий.
При этом в митохондриальном матриксе pH менялся почти сразу после «включения» протонного насоса Arch3, а генерация АФК начиналась с запозданием. Результат указывает на то, в «щелочном апоптозе» клеток важную роль играет образование перекиси и подобных ей соединений, однако детали этой сложной взаимосвязи еще предстоит выяснить.
«Мы показали, что длительное оптогенетическое защелачивание цитозоля (раствора внутри клетки) приводит к генерации активных форм кислорода в клетке, своеобразному «кислородному взрыву». Это может быть одним из механизмов, запускающих клеточную гибель при повышении рН цитозоля. Изучение взаимосвязи внутриклеточного рН и уровня АФК важно как для понимания фундаментальных основ клеточной физиологии, так и для осмысления нарушений, происходящих, например, при злокачественной трансформации клеток, при онкологических болезнях или при развитии нейродегенерации», — отметила Анастасия Власова, старший научный сотрудник лаборатории молекулярной клеточной биологии и оптогенетики Центра исследования молекулярных механизмов старения и возрастных заболеваний МФТИ.