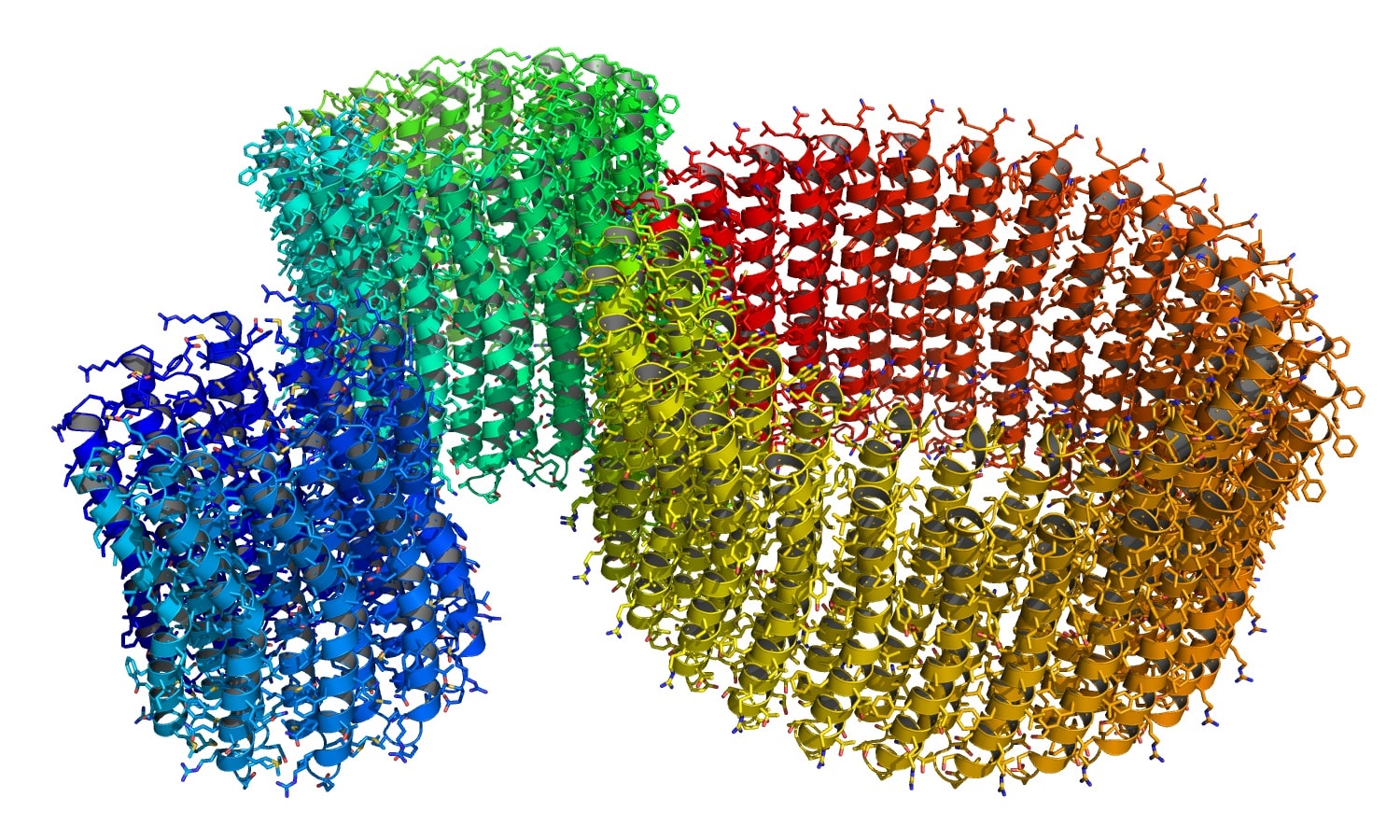
Работа опубликована в журнале PROTEINS: Structure, Function, and Bioinformatics. АТФ-синтаза использует потенциал на мембране для синтеза молекул аденозинтрифосфата (АТФ) — универсального «топливного элемента» живых систем. Этот фермент можно сравнить с электрическим мотором: у него есть неподвижная часть — статор и вращающаяся — ротор, который также называют с-кольцо. Ионы, переносимые АТФ-синтазой через мембрану, способствуют вращению ротора и синтезу АТФ статором. Сам ротор состоит из повторяющихся частей (с-субъединиц), количество которых и определяет, сколько ионов будет проходить через мембрану за один оборот и какого потенциала достаточно для работы белка.
Известны АТФ-синтазы, содержащие от восьми до 17 с-субъединиц. рентгеновскую кристаллографию или крио-электронную микроскопию. Однако развитие методов машинного обучения привело к созданию ряда прорывных подходов, в том числе и для предсказания белковых структур. Разработчики наиболее известного из них — AlphaFold — в 2024 году были удостоены Нобелевской премии по химии. При этом обычный AlphaFold не очень хорошо работает с большими белковыми комплексами, к которым относятся и АТФ-синтазы.
В своей работе исследователи из МФТИ предложили новый подход на основе AlphaFold, который позволил уверенно предсказывать количество субъединиц в белковых комплексах с вращательной симметрией. Для известных данных корреляция между предсказанием и экспериментальными значениями превзошла 90 процентов. Более того, подход оказался очень быстрым, благодаря чему стало возможно оценить количество субъединиц в АТФ-синтазах очень разных живых организмах.
«Самое неожиданное в наших результатах — это предсказание существования в природе микроорганизмов с очень крупным с-кольцом у АТФ-синтаз, в котором может быть до 27 повторяющихся субъединиц! Ранее в экспериментах ученые находили максимум 17 с-субъединиц. Что важно, моделирование методом молекулярной динамики подтверждает результаты этих предсказаний», — говорит Степан Осипов, первый автор опубликованной работы, аспирант Физтех-школы физики и исследований имени Ландау МФТИ.
Зачем природе нужны такие необычно большие с-кольца, если более «стандартные» роторы также демонстрируют высокую эффективность? Ответ на этот вопрос тесно связан с тем, в каких условиях обитают эти организмы. Возможно, они существуют при высоких температурах или в агрессивных средах, в которых постоянно теряют ионы через свои мембраны. Или дело может быть в малом энергетическом потенциале на мембране — тогда высокая кратность повторений в с-кольце призвана лучше «ловить» редкие протоны или ионы натрия. Подобные крупные роторы «потратят» больше протонов за один оборот, но позволят синтезировать АТФ при значительно меньших трансмембранных потенциалах. Чтобы проверить эти предположения, потребуются уже экспериментальные исследования реальных микроорганизмов, у которых по расчетам должны быть такие необычные с-кольца АТФ-синтаз.
«Это также означает, что для многих областей биотехнологии открываются новые возможности. К примеру, если научиться конструировать молекулярные “двигатели” с заданными параметрами, можно целенаправленно подстраивать эффективность энергетического обмена в клетках, создавать микроорганизмы для производства различных соединений в условиях, где традиционные штаммы не выживают», — комментирует Алексей Власов, старший научный сотрудник, и.о. заведующего лаборатории молекулярной клеточной биологии и оптогенетики МФТИ.
«Наша работа подсвечивает важность вычислительных алгоритмов на основе машинного обучения и искусственного интеллекта в современной структурной биологии, а также открывает новые возможности для поиска интересных белков в геномных данных и инженерии новых белков с заданными свойствами», — подытоживает Иван Гущин, исполнительный директор Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ.
Работа выполнена при поддержке Российского научного фонда и Министерства науки и высшего образования России.