Работа, опубликованная в журнале Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology, поддержанная грантом Российского научного фонда, открывает перспективы для создания новых биосенсоров и оптических материалов.
Обитающие в суровых условиях полярных широт микроорганизмы, в частности бактерия Hymenobacter psoromatis, обладают уникальными генетически запрограммированными механизмами выживания, позволяющими им существовать и развиваться при низких температурах и под воздействием ультрафиолетового ионизирующего излучения.
Бактерия имеет и гены специальных светочувствительных белков — родопсинов. В отличие от зрительного родопсина животных, эти бактериальные белки работают как ионные насосы или сенсоры, преобразуя энергию света в химические сигналы или электростатический потенциал на мембране. Особенность изучаемого родопсина — его возможная связь с молекулой каротиноида (оранжево-красным пигментом). Ученые давно предполагали, что каротиноид в таких комплексах может играть две критически важные роли: служить дополнительной «антенной», расширяющей диапазон улавливаемого света, и защищать белок от повреждающего действия ультрафиолетового излучения, интенсивного в полярных регионах. Однако детали молекулярных механизмов их совместной работы до сих пор были изучены мало.
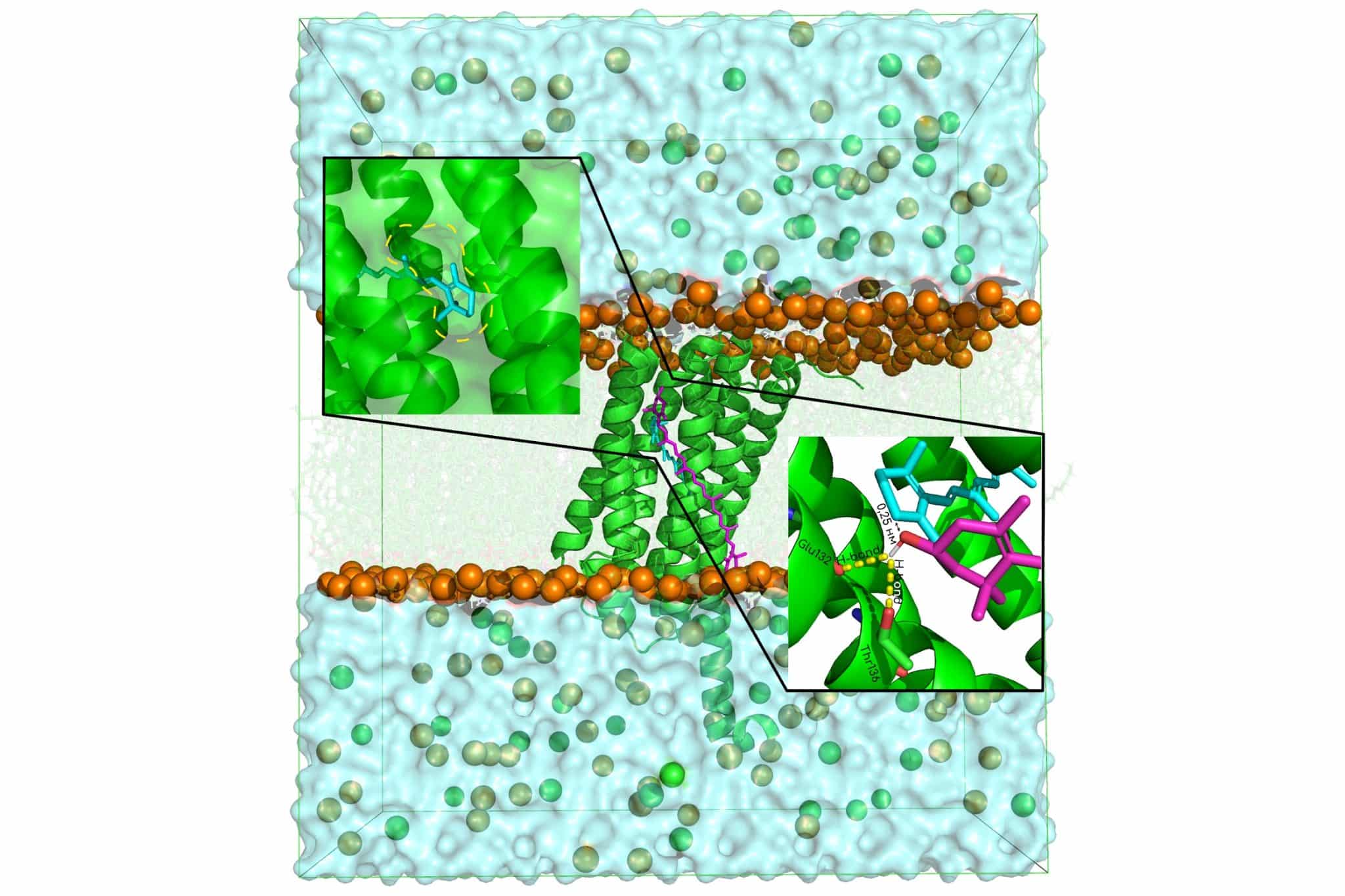
Чтобы увидеть, как именно устроен и работает этот тандем, группа исследователей МФТИ провела множество итераций специального длительного компьютерного моделирования с помощью методов молекулярной динамики. Ученые начали работу с конструирования модели структуры родопсина бактерии. Трехмерную модель белка вместе с молекулами ретиналя и зеаксантина построили с помощью новой ИИ-платформы Chai-1. Использовать знаменитый «нобелевский» алгоритм AlphaFold3 исследователям помешало то, что он поддерживает лишь ограниченное число лигандов, в которое не входит ни ретиналь, ни молекулы каротиноидов. Однако предсказанная искусственным интеллектом структура не полностью соответствовала известным принципам работы таких комплексов — пигменты оказались слишком далеко друг от друга. Тогда исследователи применили шаблонный докинг — метод компьютерного моделирования в структурной биологии, который используется для предсказания строения молекулярного комплекса на основе уже известных, похожих структур. В качестве «шаблона» был выбран родственный комплекс ксантородопсина и каротиноида. Полученная модель показала, что пигменты сближены до критически важного расстояния около 0,3 нанометра, а в структуре белка между ними сохраняется специальное «фенестрационное окно» — туннель, необходимый для переноса энергии.
Главным испытанием для модели стала длительная компьютерная симуляция — множество итераций по 1 микросекунде для молекулярно-динамического моделирования в виртуальной клеточной мембране (составленной из липидов, обнаруженных экспериментально в таких бактериях) при температуре, соответствующей антарктическому холоду (+5°C). Расчеты подтвердили, что комплекс не распадается, а сохраняет стабильную архитектуру во времени. Каротиноид прочно удерживается у поверхности белка благодаря двум постоянным водородным связям с производными аминокислот глутамина (Glu132) и треонина (Thr136). Это обеспечивает постоянную сверхмалую дистанцию (всего 0,25 нм) между ретиналем и самым близким атомом каротиноида — условие, необходимое для быстрого и эффективного переноса энергии поглощенного света. Сходимость результатов и устойчивость всей конструкции в ходе симуляции, судя по всему, свидетельствует, что ученым удалось создать адекватную модель реально существующего в природе «светособирающего устройства».
«Главное, что длительные итерации моделирования показали стабильность во времени минимального расстояния между каротиноидом и ретиналем и постоянное наличие фенестрационного окна в структуре белка между ними. Это дает основания полагать, что полученная с помощью новейших методов биоинформатики и молекулярной динамики структурная модель белка близка к реальной, — пояснил Иван Охрименко, заведующий лабораторией старения и возрастных нейродегенеративных заболеваний МФТИ. — Сейчас мы, планируя, что будет продолжена финансовая поддержка РНФ, работаем над тем, чтобы проверить наши расчеты экспериментально. Эксперимент продемонстрирует, насколько современные методы молекулярного моделирования и биоинформатики точны и могут предсказывать еще неизвестные детали структурной организации мембранных белков».
Это исследование — очередной шаг к пониманию того, как микроорганизмы выживают в экстремальных условиях, используя минимум солнечного света. Полученные данные не только расширяют фундаментальные знания о механизмах поглощения электромагнитного излучения микроорганизмами, но и имеют прикладное значение. Понимание принципов работы природных «антенн» может привести к созданию новых биосенсоров, более эффективных систем для оптогенетики или искусственных светособирающих комплексов для альтернативной энергетики.