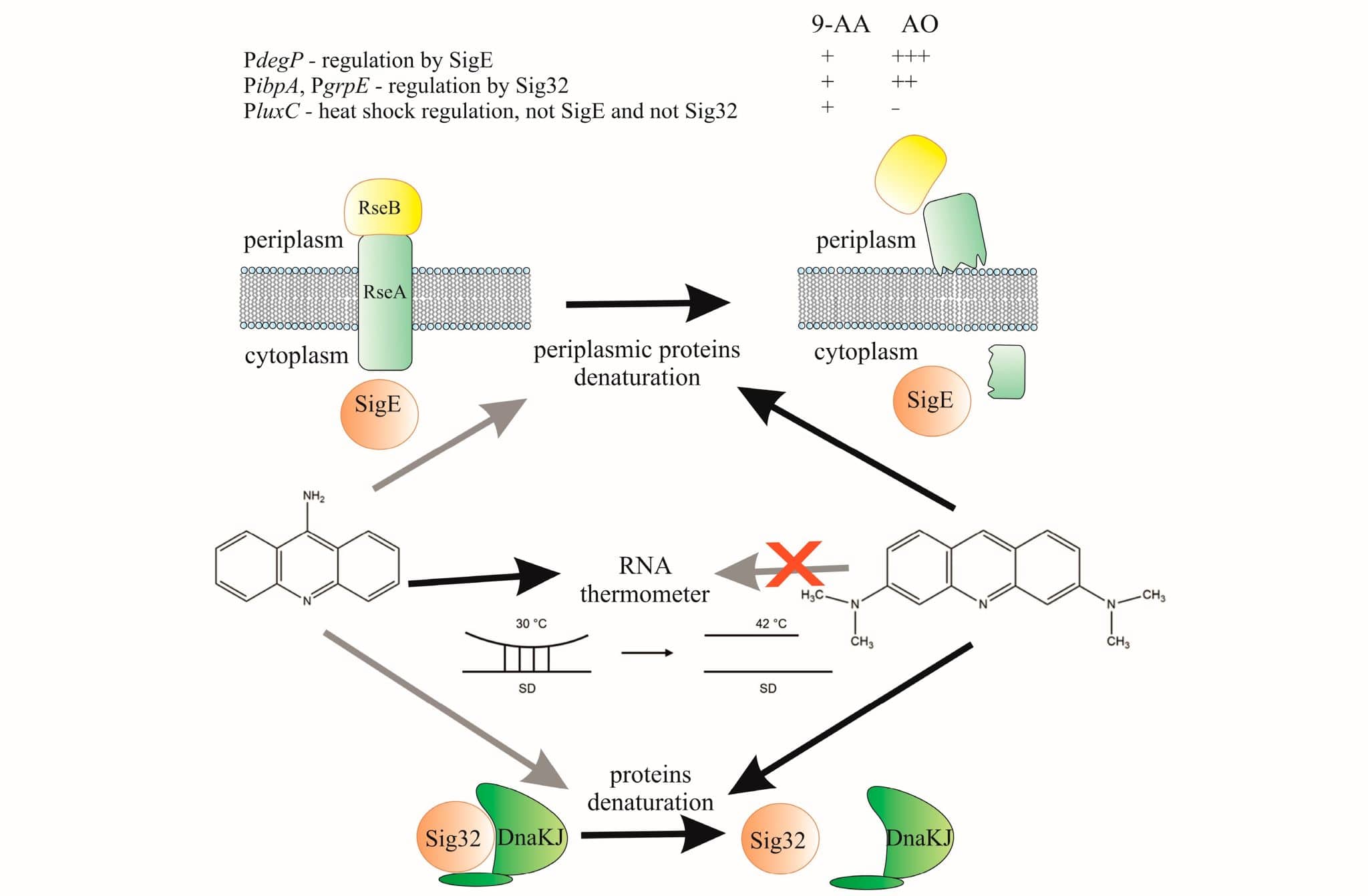
Среди используемых в медицине препаратов есть взаимодействующие с ДНК со своими побочными эффектами. В рамках нового исследования ученые предположили, что некоторые лекарства (в частности, акридиновые красители) могут денатурировать белки. То есть нарушать их природную трехмерную форму, что делает невозможным выполнение биологических функций. В результате в клетке развивается состояние теплового шока. Это неспецифический ответ, помогающий пережить разного рода негативные воздействия, вызывающие «поломку» белков. Причиной может быть не только перегрев, но и, скажем, эффект токсических веществ или радиации.
Ученые исследовали красители 9-аминоакридин и акридин оранжевый — вещества с известными мутагенными свойствами. При этом первый используют как антисептик, второй — для фотодинамической терапии онкологических заболеваний. Оба препарата вызывают мутации со сдвигом рамки считывания, при которых вставка или выпадение нуклеотидов «сбивают» прочтение последовательности ДНК. Это связано с интеркаляцией — проникновением таких красителей между азотистыми основаниями нуклеиновой кислоты.
Эти мутагены также могут влиять на состояние других компонентов клетки, в том числе белков. И тем самым вызывают у принимающих их пациентов нежелательные эффекты. Чтобы прояснить вопрос, ученые использовали люминесцентные биосенсоры (lux-биосенсоры) на основе рекомбинантных бактерий кишечной палочки Escherichia coli.
Это клетки микробов, в которые ввели нужные для люминесценции гены в связке с «переключателями» — чувствительными к тепловому шоку промоторами. Если такие «живые сенсоры» испытывали стресс, то активация генов люминесценции и синтез соответствующих белков вызывали свечение. Оно наглядно говорило о запуске реакции теплового шока, которую таким образом можно количественно оценить.
В работе ученым также помогли методы количественной ПЦР с обратной транскрипцией в реальном времени (RT-qPCR) и нанодифференциальная сканирующая флуориметрия (nanoDSF). Первый позволяет оценить, насколько увеличился синтез РНК генов теплового шока, второй оценивает стабильность трехмерной формы белков по их «собственному» свечению (флуоресценции ароматических аминокислот). Результаты опубликованы в журнале Biosensors.
Оказалось, что исследованные акридиновые красители действительно запускают реакцию теплового шока у бактерий. Несмотря на очень похожее строение молекул, два акридиновых красителя повели себя в эксперименте по-разному, показав отличия в механизме воздействия на белки. Только один из них — акридин оранжевый — вызывал денатурацию белков. То есть нарушил их трехмерную форму, переведя в неупорядоченное состояние, при котором невозможно выполнение биологической функции.
Это было проверено на люциферазе — белке, из-за которого клетки E. coli люминесцируют. Краситель снизил температуру плавления как люциферазы, так и более устойчивого к нагреванию белка L-метионин-гамма-лиазы (MGL).
Акридин оранжевый активировал определенные промоторы и защитные механизмы клетки теплового шока, а именно опосредованные белками sigma E и sigma 32. При этом 9-аминоакридин слабее денатурировал белки и «включал» sigma E механизм в меньшей степени, зато активировал промотор PluxC из бактерии Photorhabdus luminescens.
PluxC также чувствителен к повышенной температуре, однако работает иначе. По-видимому, он активируется системой ответа на тепловой шок за счет денатурации уже не белка, а матричной РНК. Точнее, образованной ею шпильки — устойчивой изогнутой структуры.
Отлаженный алгоритм работы с клеточными биосенсорами в данном случае встретил затруднения, связанные с особенностями тестируемых веществ. Высокая общая токсичность и эффект экранирования люминесценции акридином оранжевым затрудняли использование lux-биосенсоров. А чувствительность RT-qPCR оказалась недостаточной, чтобы точно зафиксировать реакцию теплового шока, вызванного 9-аминоакридином.
Отсюда следует вывод, что для исследований активации белков теплового шока или влияющих на люминесценцию препаратов лучше использовать люминесцентные биосенсоры и RT-qPCR совместно.
«В результате исследования показано, что производные акридина — 9-аминоакридин и акридин оранжевый — способны вызывать клеточный тепловой шок. Этот эффект, что примечательно, отличается для двух производных акридина: акридин оранжевый достаточно сильно нарушает структуру белков, в то время как 9-аминоакридин скорее расплетает вторичную структуру матричной РНК, активируя последующее состояние теплового шока. Знание о способности веществ вызывать тепловой шок может быть использовано для разработки технологии в сочетании с лучевой терапией рака. Например, добавление супрессоров теплового шока может усилить фармакологическое действие акридинов. Относительная репрезентативность и простота исследования достигнуты с помощью цельноклеточных биосенсоров на основе клеток E. coli с гибридными плазмидами: pGrpE-lux, pIbpA-lux, pGrpE-lux и pXen7. Это люминесцирующие бактерии, свечение которых возрастает в случае теплового шока под контролем различных генетических механизмов, что позволяет судить о конкретном механизме ответа на стресс», — отметил руководитель работы, заведующий лабораторией молекулярной генетики МФТИ Илья Манухов.