Несмотря на то, что геномы человека и шимпанзе, наших ближайших сохранившихся родственников, совпадают более чем на 98%, люди значительно чаще страдают от онкологических заболеваний. Это несоответствие указывает на существование тонких, но важных генетических отличий, которые появились в ходе эволюции человеческой линии. Их поиск может раскрыть фундаментальные причины предрасположенности людей к раку и подсказать новые пути для борьбы с ним.
Одна из перспективных областей современной онкологии — иммунотерапия. Подход использует ресурсы иммунной системы пациента, чтобы уничтожить раковые клетки. Например, терапия CAR-T клетками с химерным антигенным рецептором, основанная на активации Т-клеток, эффективна в лечении рака крови.
В борьбе с солидными опухолями — плотными образованиями, такими как рак молочной железы, яичников или толстой кишки — эффективность иммунотерапии остается ограниченной. Опухолевое микроокружение создает барьеры, которые мешают иммунным клеткам выполнять работу. Понимание этих барьеров — ключ к созданию более универсальных и мощных методов лечения.
Центральную роль в противоопухолевом иммунитете играет белок Fas-лиганд, или FasL. Он находится на поверхности активированных иммунных клеток, включая клетки Т-киллеры. Когда Т-киллер обнаруживает раковую клетку, его FasL связывается с рецептором Fas на поверхности опухолевой клетки. Это запускает в последней апоптоз, программу клеточного самоубийства.
По сути, FasL — это смертельное оружие иммунитета. Новое исследование посвящено вопросу, почему это оружие часто дает осечку в среде солидных опухолей человека.
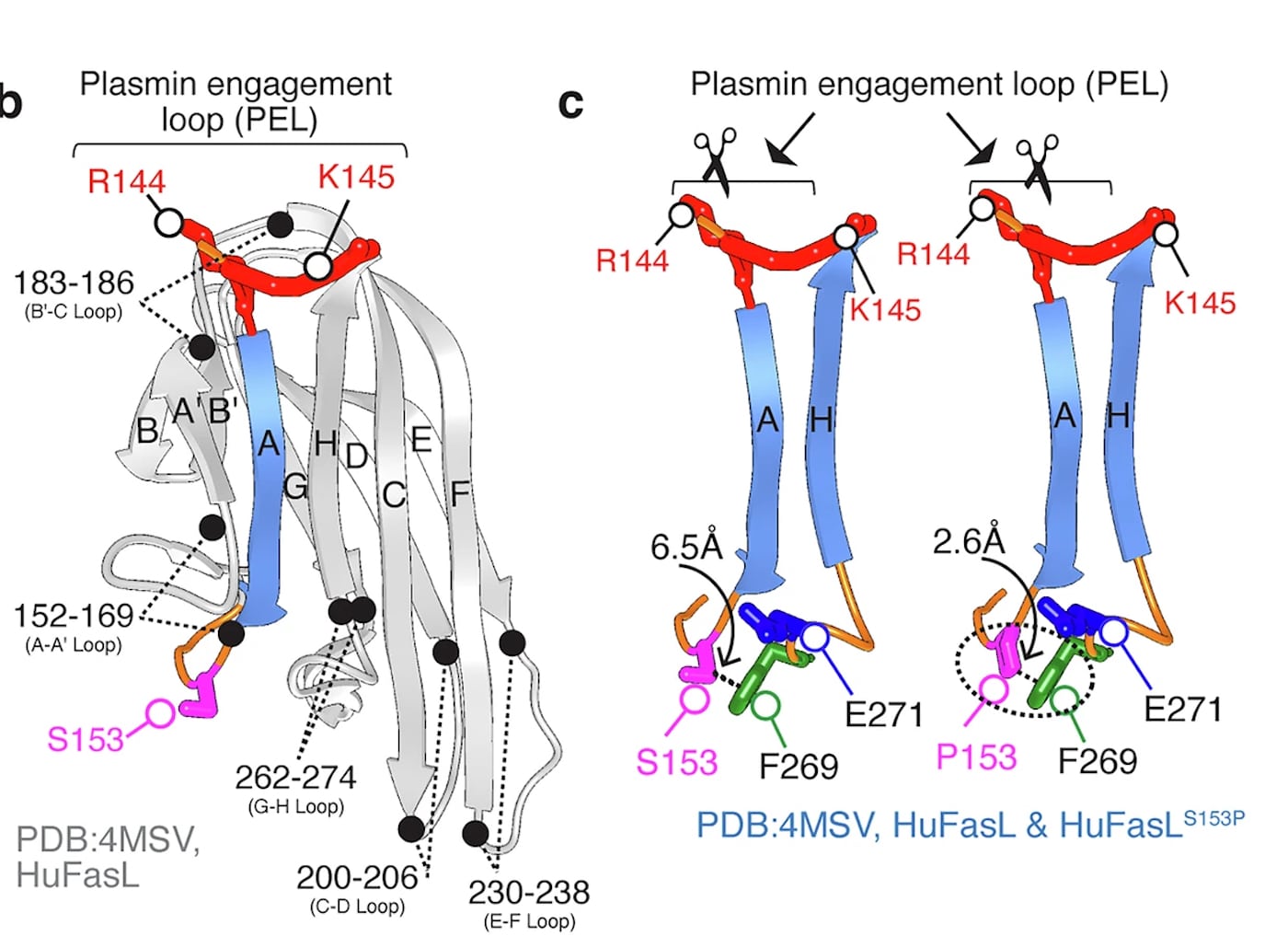
Ученые провели детальный анализ гена, который кодирует белок FasL. Они сравнили последовательности белка у людей и других приматов, включая шимпанзе и макак-резусов. Результаты работы опубликованы в журнале Nature Communications.
Нашлось всего одно, решающее отличие в человеческой версии белка. В позиции 153 в аминокислотной цепи у человека стоит аминокислота серин, в то время как у остальных исследованных приматов в этом месте находится пролин. Дальнейшие эксперименты показали, что эта замена фатальным образом меняет свойства белка. Человеческий FasL c серином оказался крайне уязвимым для фермента плазмина.
Плазмин — это протеаза, то есть фермент, который расщепляет другие белки. Он активно вырабатывается многими агрессивными солидными опухолями, помогая разрушать окружающие ткани и метастазировать. Когда плазмин встречает человеческий FasL, плазмин разрезает его и тем самым полностью инактивирует. В то же время FasL приматов с пролином устойчив к действию плазмина. Пролин стабилизирует структуру белка и защищает его от атаки фермента.
Чтобы доказать причинно-следственную связь, ученые провели серию лабораторных тестов. Они создали рекомбинантные белки: обычный человеческий FasL, FasL макаки-резуса, а также две гибридные версии. В одной в человеческий FasL вернули «обезьяний» пролин, а в другой, наоборот, в FasL макаки вставили «человеческий» серин. Результаты были однозначными: любая версия FasL с серином расщеплялась плазмином, а любая версия с пролином оставалась невредимой.
Исследователи предположили, что если защитить человеческий FasL от плазмина, то противоопухолевая функция восстановится. Они проверили эту гипотезу двумя способами. Во-первых, использовали апротинин, это ингибитор плазмина. Во-вторых, разработали антитела, которые связывались с FasL рядом с местом разреза и физически мешали плазмину добраться до цели.
Оба подхода сработали. В присутствии ингибитора или защитных антител человеческий FasL снова мог уничтожать раковые клетки в среде с высоким содержанием плазмина. Теперь ученые планируют скомбинировать существующие виды иммунотерапии с блокаторами плазмина, чтобы резко повысить эффективность против солидных опухолей.
Помимо практической пользы, работа проливает свет на сложную историю эволюционных компромиссов. Мутация, которая сделала людей более уязвимыми к раку, могла быть полезной в другом контексте. Авторы выдвинули гипотезу, что ослабление функции FasL могло сыграть роль в увеличении размера мозга у предков человека.
Белок FasL участвует в регуляции апоптоза не только в иммунной системе, но и в ходе эмбрионального развития, в том числе в нервной системе. Ограничение его активности могло привести к меньшему отмиранию нейрональных клеток-предшественников, что способствовало росту коры головного мозга.
Таким образом, более высокий интеллект мог быть приобретен ценой повышенного риска развития онкологических заболеваний — классический пример антагонистической плейотропии, когда один ген оказывает разнонаправленное влияние на разные признаки организма.