Митохондрии — энергетические станции клетки — содержат собственную ДНК, которая со временем повреждается из-за окислительного стресса. Накопление дефектов в ней вызывает сбои в выработке энергии, ускоряет старение и провоцирует нейродегенеративные заболевания.
Ранее ученые знали, что клетки способны удалять целые поврежденные митохондрии через аутофагию, но механизмы точечного «ремонта» оставались загадкой. Новое исследование, опубликованное в журнале Science Advances, раскрывает, как именно происходит пересборка дефектной митохондриальной ДНК.
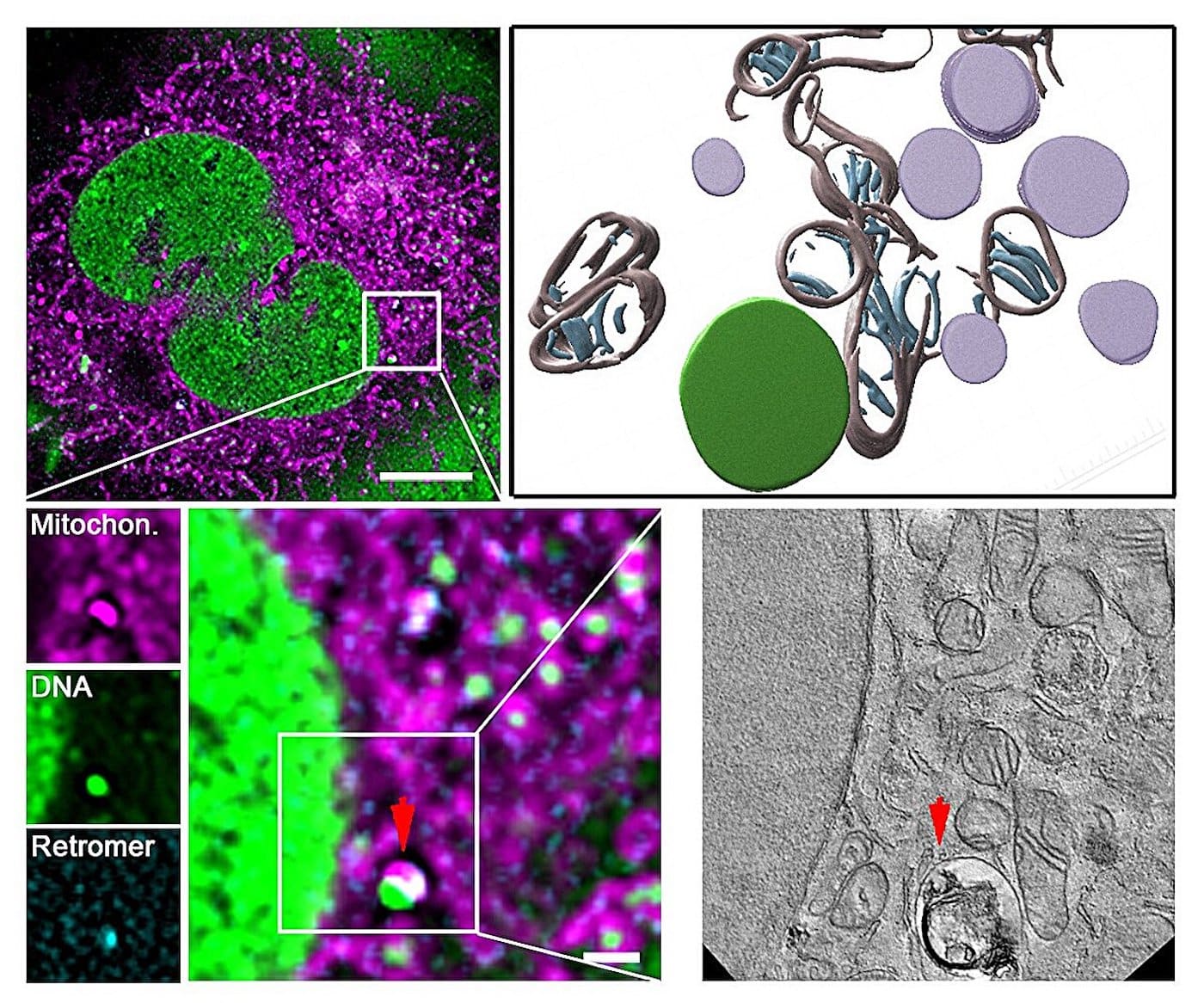
С помощью метода пространственной протеомики биологи выявили, что при стрессе митохондрии активно взаимодействуют с лизосомами — клеточными «перерабатывающими центрами». При искусственном повреждении митохондриальной ДНК с помощью мутации белка Twinkle активировался белковый комплекс ретромера, включая ключевой компонент VPS35.
Этот комплекс формирует везикулы — микроскопические пузырьки, которые отделяют поврежденные участки ДНК от здоровых и направляют их в лизосомы. Там ферменты расщепляют дефектный генетический материал.
Эксперименты на человеческих клетках линии HeLa показали: подавление VPS35 увеличивало количество поврежденной митохондриальной ДНК на 60%, а его активация ускоряла «чистку» в три раза. Ученые подтвердили результаты на плодовых мушках: у насекомых с искусственными мутациями митохондриальной ДНК активация VPS35 восстановила функции митохондрий на 80% и устранила дефекты развития.
Применив метод корреляционной световой и электронной микроскопии CLEM, исследователи визуализировали этот процесс: ДНК покидает митохондрии через поры, образованные белком — регулятором апоптоза BAX, и сразу попадает в везикулы, избегая накопления в цитоплазме.
Открытие механизма лизосомальной утилизации митохондриальной ДНК объясняет, как клетки предотвращают «засорение» поврежденной ДНК. Управление активностью ретромера может стать стратегией для предотвращения накопления повреждений в митохондриях и поддержания здоровья клеток.