Результаты исследования опубликованы в международном научном журнале Biomolecules. Сегодня ученые по всему миру активно исследуют различные метаболические заболевания (остеопороз, ожирение и другие), в последние годы темпы их распространения растут, особенно в развитых странах. Это объясняется склонностью к малоподвижному образу жизни и неправильному питанию людей в мегаполисах. Среди видимых последствий развития метаболического синдрома ученые выделяют серьезные сердечно-сосудистые заболевания, гипертонию, диабет второго типа и другие.
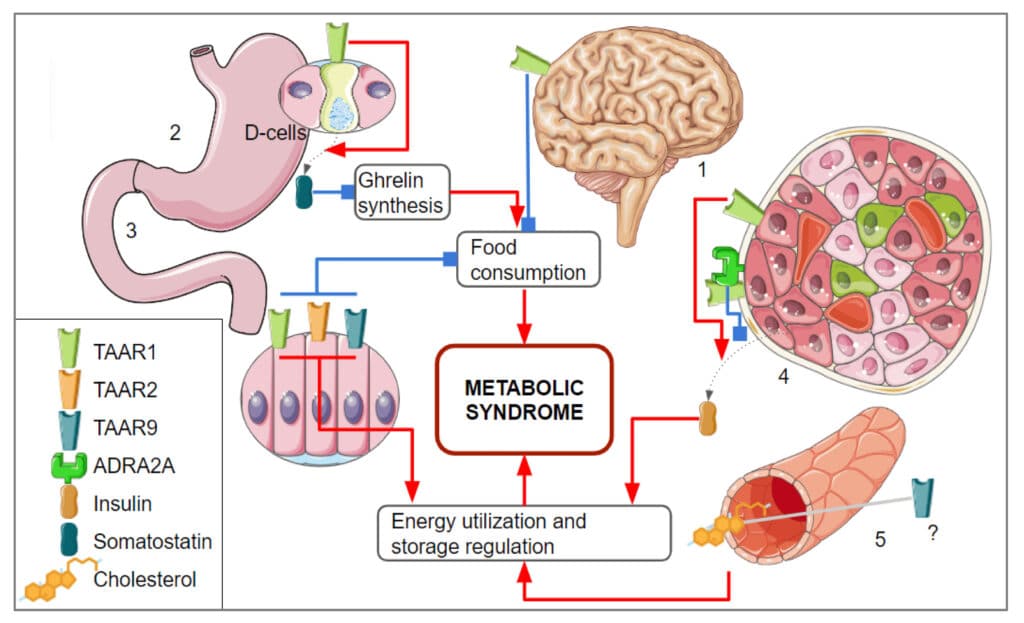
Исследования ученых показывает, что антипсихотические (нейролептические) препараты нового поколения, мишенью которых является рецептор следовых аминов TAAR1, и которые призваны улучшать ментальное состояние людей, способны оказывать благотворное воздействие на энергетический метаболизм. Это свойство выгодно отличает их от многих применяемых в настоящее время антипсихотиков, которые, напротив, способствуют набору веса.
Рецепторы следовых аминов, к которым относится TAAR1 способны влиять на работу других, более изученных сигнальных путей, лежащих в основе работы нервной системы, в том числе дофаминового, серотонинового и норадреналинового. Следовые амины известны благодаря своей роли в работе нервной системы, однако они участвуют и в регуляции работы других органов. В эту группу соединений входят, например, производное гормонов щитовидной железы 3-йодотиронамин и октопамин, применяемый в качестве биоактивной добавки.
Так, ранее ученые Санкт-Петербургского университета обнаружили, что активация TAAR1 может частично улучшать память и предотвращать развитие психозов у людей.
Следует отметить, что следовые амины участвуют и в процессе регуляции выделения инсулина в поджелудочной железе. Это происходит благодаря клеткам поджелудочной железы, называемым островки Лангерганса. Островки Лангеранса включают в себя более 300 различных рецепторов, в том числе TAAR1. Воздействуя на TAAR1 в клетках поджелудочной железы можно влиять на секрецию инсулина. Таким образом, можно не только повлиять на выделение инсулина и поддержание нормального функционирования клеток островков Лангерганса, но также нормализовать пищевое поведение и коррекцию переедания на уровне нервной системы, поскольку TAAR1 отвечает за дофаминовую систему.
«Мы обнаружили, что рецепторы следовых аминов экспрессируются в клетках поджелудочной железы. Эти клетки продуцируют инсулин и регулируют этот процесс, совместно с другими рецепторами, ответственными за восприятие экзогенных веществ, а именно обонятельными и вкусовыми. Такая взаимосвязь может указывать на то, что рецепторы следовых аминов регулируются совместно с близкими по свойствам рецепторами химических веществ, а также на то, что они, возможно, участвуют в общем регуляторном процессе», — рассказала научный сотрудник лаборатории нейробиологии и молекулярной фармакологии СПбГУ Анастасия Ваганова.
По словам руководителя исследования, директора института трансляционной биомедицины СПбГУ и научного руководителя Клиники высоких медицинских технологий имени Н. И. Пирогова СПбГУ Рауля Гайнетдинова, это открывает новые перспективы для фармакологической коррекции диабета и сопутствующих заболеваний.
При этом оказалось, что взаимосвязи с экспрессией других генов для наиболее изученного, TAAR1, теряются, когда у человека развивается метаболический синдром или, тем более, диабет. То есть сигнальные пути, в работе которых участвует TAAR1, перестают нормально работать. Кроме того, Рауль Гайнетдинов отметил, что набор рецепторов на поверхности клеток островков Лангерганса непостоянен и быстро изменяется в зависимости от времени суток и иных воздействий.
Экспрессия генов рецепторов следовых аминов в этих структурах, таким образом, связана с состоянием, в котором для нормального функционирования клеток важно собирать информацию о поступающих во внутреннюю среду организма соединениях. Следующие исследования ученых СПбГУ будут посвящены изучению особенностей этого процесса.