Рак остается одной из основных причин смертности в мире, уступая лишь сердечно-сосудистым заболеваниям. Несмотря на значительный прогресс в ранней диагностике и терапевтических инновациях, поздняя стадия по-прежнему плохо поддается лечению, а химиотерапия остается основным грубым инструментом. Токсичные препараты атакуют все быстро делящиеся клетки без разбора, что приводит к тяжелым побочным эффектам, самые негативные из которых — необратимое повреждение сердечной мышцы и почечная недостаточность.
Более 120 лет назад нобелевский лауреат Пауль Эрлих сформулировал идею «магической пули» — лекарства, способного избирательно поражать болезнь, не затрагивая здоровые ткани. На протяжении десятилетий эта концепция оставалась скорее философским ориентиром для медицины, чем практической технологией. Однако сегодня можно сказать, что первая «магическая пуля» действительно создана и применяется в клинической практике.
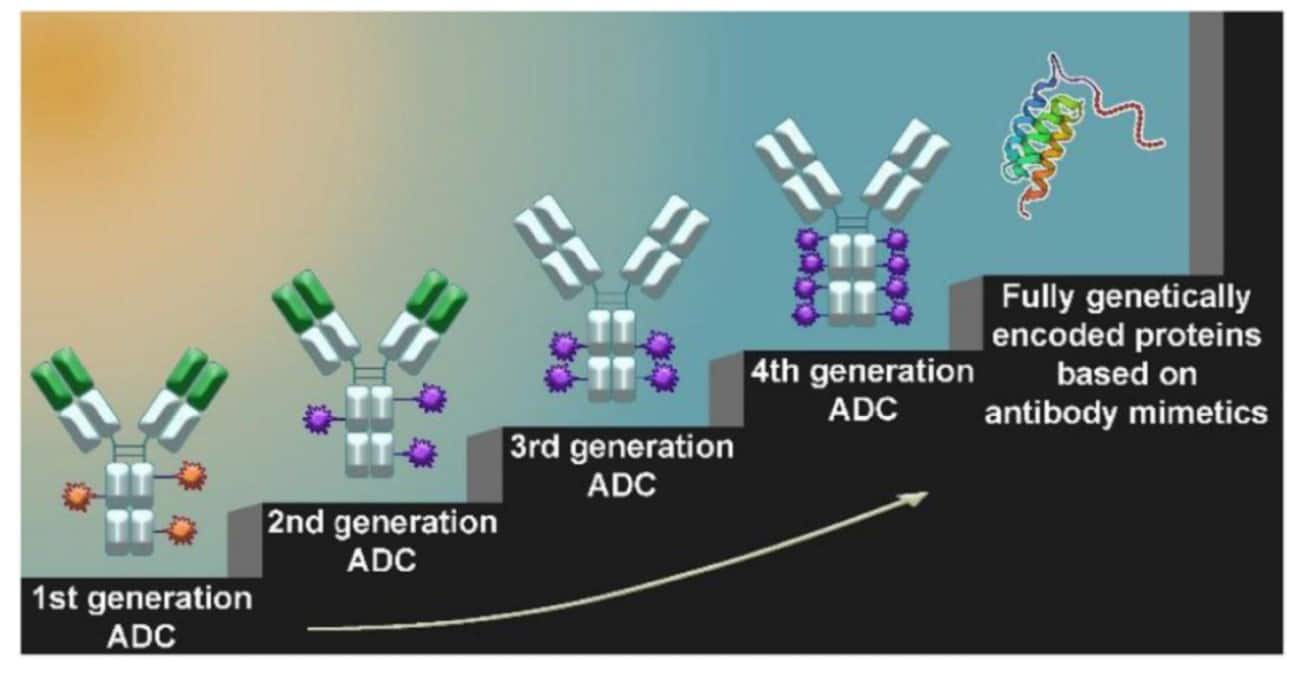
Речь идет о препаратах на основе антител. Эти природные белки иммунной системы обладают уникальной способностью с высокой точностью распознавать молекулярные мишени на поверхности опухолевых клеток. Соединив такую способность к прицельному распознаванию с противоопухолевым действием, исследователи создали антитело-лекарственные конъюгаты (ADC) — гибридные молекулы, в которых антитело доставляет токсичный «груз» непосредственно в раковую клетку. Именно ADC сегодня наиболее близко соответствуют изначальной идее Эрлиха и уже представлены реальными препаратами, доступными пациентам.
Помимо ADC, в современной онкологии используются и другие подходы адресной терапии, такие как, например, ингибиторы иммунных контрольных точек, которые снимают «тормоза» с иммунной системы, позволяя Т-лимфоцитам эффективнее уничтожать опухоль или CAR-T-клеточная терапия, основанная на генетической модификации собственных Т-лимфоцитов пациента для высокоточного распознавания опухолевых мишеней.
Тем не менее именно антитело-лекарственные конъюгаты сегодня считаются наиболее реализованным воплощением концепции «магической пули», доказавшим эффективность в клинике и ставшим стандартом терапии для ряда онкологических заболеваний.
В клинической практике применяются уже 18 ADC, спасающих жизни пациентам с определенными типами рака груди, легких, лимфом и лейкозов. Но несмотря на значительный клинический успех эта технология до сих пор сталкивается с фундаментальными ограничениями. Эти проблемы стимулируют ученых искать альтернативные пути, более совместимые с масштабируемой и стандартизированной биотехнологией.
В итоге ученые из лаборатории биохимических исследований канцерогенеза Института биофизики будущего МФТИ, проведя масштабный анализ препаратов адресной доставки, пришли к выводу, что «магическая пуля» имеет существенные конструктивные недостатки. Работа опубликована в журнале Biochemical and Biophysical Research Communications и выполнена при поддержке гранта Министерства науки и высшего образования РФ.
Антитела — это крупные, сложные белки, которые можно производить только в дорогих культурах животных клеток. Химическое присоединение токсина к антителу часто происходит хаотично, что приводит к неоднородности препарата. Такая нестабильность чревата преждевременным высвобождением токсина в кровоток, что ведет к тяжелым побочным эффектам. Сложности производства приводят к высокой стоимости препаратов. Так, на годовой курс одного из наиболее популярных ADC Кадсила нужно от семи до 11 миллионов рублей, что делает этот вид терапии практически недоступным для большинства пациентов.
«Наша работа представляет собой некий исследовательский скрининг, обобщающий достижения и проблемы препаратов формата антитело-лекарственный конъюгат. На сегодняшний день препаратов на основе антител для терапии достаточно много, и все они имеют свои достоинства и недостатки. Например, моноклональные антитела, произошедшие из одной клетки, часто отличаются недостаточной эффективностью либо сильными побочными эффектами. Терапия с помощью конъюгатов ADC — соединений антител с сильным токсином — обладает гораздо большей эффективностью, однако и побочные эффекты гораздо выше. Кроме того, сам процесс изготовления таких препаратов высокотоксичен и основан на очень сложной и опасной бромциановой химии», — рассказала об исследовании д. б. н. Виктория Шипунова, заведующая лабораторией биохимических исследований канцерогенеза МФТИ.
В обзоре ученые делают ставку на полный отказ от классической архитектуры ADC в пользу полностью белковых, генетически запрограммированных конструкций. Их идея заключается в том, чтобы объединить две функции, а именно: нацеливания и убийства раковых клеток, в одной компактной полипептидной цепи, которую можно будет легко и дешево производить в бактериях, таких как кишечная палочка.
«Сегодня, учитывая высокую стоимость лечения, активно развиваются так называемые миметики антител — синтетические белки, основу которых любопытные ученые подглядели у природы. Научились варьировать их структуру и создавать на их основе белки, распознающие молекулярные мишени не хуже, чем это делают природные антитела. Такие белки также обладают свойствами распознавания молекулярных мишеней, но при этом лишены очень многих недостатков моноклональных антител. Миметики антител могут эффективно нарабатываться в бактериальных системах экспрессии, в отличие от моноклональных антител, требующих дорогих эукариотических клеточных культур. Эти белки обладают высокой термодинамической стабильностью, а их компактные размеры обеспечивают более эффективное проникновение в опухолевую ткань. Ключевое преимущество миметиков — возможность их полностью генетического объединения с белковыми токсинами или цитотоксическими доменами, что устраняет необходимость химической конъюгации и существенно сокращает число технологических стадий при создании препарата», — подчеркнула к. б. н. Анастасия Куртова, научный сотрудник лаборатории биохимических исследований канцерогенеза МФТИ.
В рассматриваемом подходе миметики антител представлены в виде химерных белков, совмещающих функции высокоселективного распознавания опухолевых мишеней и противоопухолевого действия за счет интеграции цитотоксических пептидов. Такие молекулы характеризуются компактной архитектурой, низкой иммуногенностью и полной совместимостью с бактериальными системами экспрессии, что делает их привлекательными как с точки зрения терапии, так и масштабируемого производства. Применение методов синтетической биологии, технологий отображения и машинного обучения существенно ускоряет разработку и оптимизацию подобных конструкций, формируя основу белковой терапии нового поколения.
Полностью генетически кодируемые химерные белки устраняют ключевое ограничение классических ADC — необходимость химической конъюгации, при которой токсические соединения могут неспецифически взаимодействовать с эндогенными субстратами, что снижает воспроизводимость и предсказуемость препарата. Отказ от этого этапа открывает путь к созданию терапевтических средств с заданными свойствами, которые можно быстро адаптировать под молекулярный профиль конкретной опухоли и производить с минимальными технологическими и экономическими затратами.
«Несмотря на очевидные преимущества белковых платформ на основе миметиков антител, исследований в этой области пока сильно меньше, чем хотелось бы. Мы довольно долго работаем в этой области, и позволив себе быть визионерами этого направления, решили написать работу, в которой довольно подробно изложили свои мысли о будущем развитии области. При этом речь идет уже не о теоретических концепциях: ряд препаратов проходит доклинические исследования и ранние стадии клинических испытаний. В частности, белковые скаффолды, компактные, стабильные и легко инженерируемые платформы, демонстрируют стремительный прогресс и начинают выходить в клинику», — подытожила Виктория Шипунова.
Таким образом, работа российских ученых представляет собой не просто обзор современного состояния области, а четко сформулированную дорожную карту перехода от эры сложных и дорогих «химических гибридов» к эпохе точных, программируемых и технологически доступных белковых терапевтических систем.