Результаты работы опубликованы в журнале Dyes and Pigments и будут полезны для развития оптических методов анализа.
В каждой аптеке можно найти эффективное и недорогое лекарственное средство — метиленовый синий. Это органическое соединение способно уничтожать болезнетворные микроорганизмы, выступать противоядием при отравлениях, регулировать активность ряда ферментов и разрушать раковые клетки. Кроме медицины метиленовый синий выступает красителем на отделочных производствах, индикатором в аналитической химии, компонентом тонирующих растворов в фотоделе.
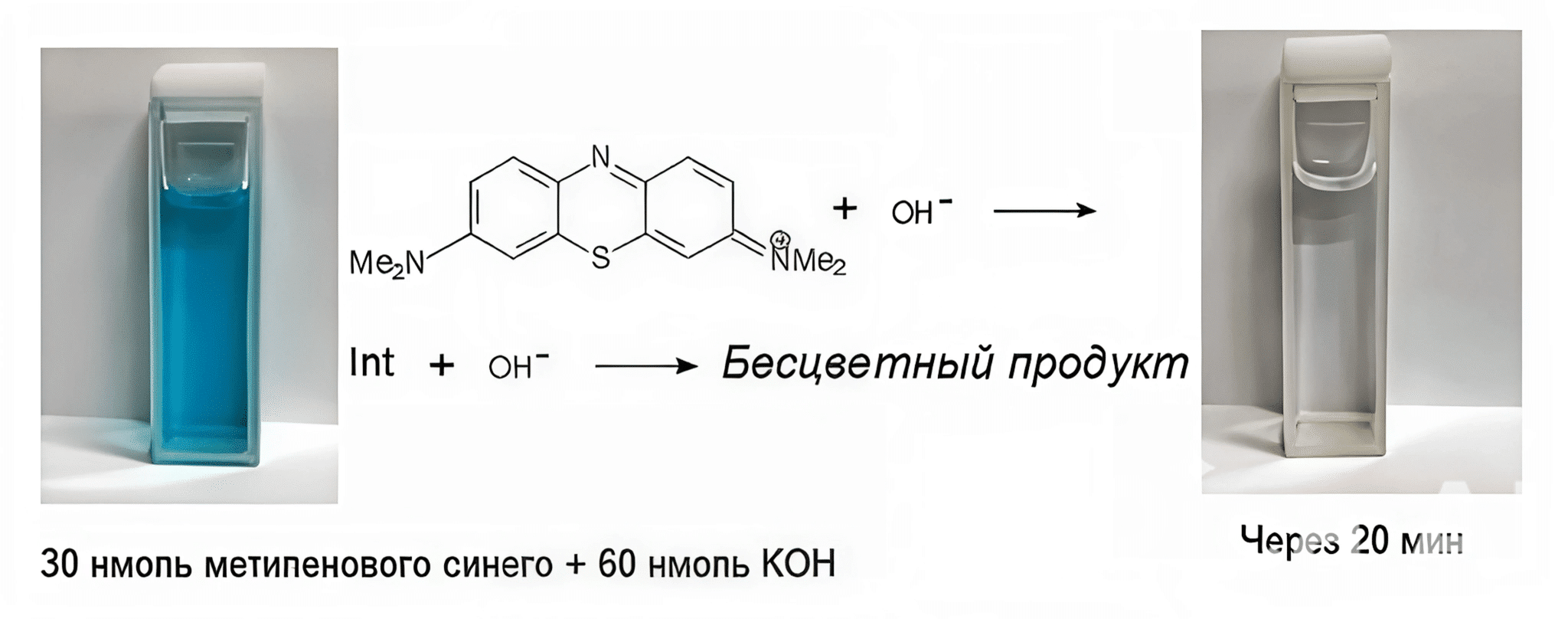
В твердом состоянии данное вещество представляет собой темно-зеленые кристаллы, малорастворимые в этаноле и воде. Растворы, содержащие восстановленную форму метиленового синего, бесцветные, но при окислении приобретают синий цвет.
Метиленовый синий — весьма загадочное соединение. Оно было синтезировано около 150 лет назад. Тем не менее, некоторые его свойства, в частности, особенности взаимодействия со щелочами, недостаточно изучены до сих пор. Ученые из ИБХФ РАН, РХТУ и МФТИ: Юрий Цаплев, Никита Костин и Алексей Трофимов — исследовали оптические свойства и химические превращения метиленового синего в суперосновной среде.
Суперосновными называют среды, состоящие из сильного основания и растворителя либо особого реагента. Этот реагент разделяет ионную пару основания и специфически связывает положительно заряженные частицы, открывая тем самым доступ к частицам с отрицательным зарядом и повышая вероятность их вступления в реакцию.
Описанное химическое взаимодействие со щелочами характерно для диметилсульфоксида. Его молекулы полярные, то есть обладают электрическим дипольным моментом. Иными словами, атомы в молекуле имеют разноименный электрический заряд из-за сдвига электронной плотности к более электроотрицательному атому. В растворе диметилсульфоксид не образует свободный ион водорода H+, в связи с чем относится к апротонным растворителям. Растворяющая способность диметилсульфоксида уникальна: она выше, чем у многих растворителей, в том числе у воды.
Суспензия гидроксида калия и диметилсульфоксида — доступная и универсальная суперосновная среда, поэтому ученые выбрали ее для экспериментов. Оптические измерения были выполнены на спектрофотометре и спектрофлуориметре в температурном диапазоне 23–25 °C. Синхронный термический анализ проведен в атмосфере азота при нагреве от 25 до 300 °C.
Ученые установили: если концентрация гидроксида калия в изучаемой системе мала, то метиленовый синий быстро обесцвечивается (Рисунок 1). Расход щелочи в 2 раза больше, чем красителя, что говорит о двухстадийном процессе. Константа скорости реакции составляет 0,039 ± 0,004 мкМ-1 ∙ мин-1.
Регистрация спектров поглощения показала (Рисунок 2), что их изменение имеет довольно простой характер. В диапазоне длин волн 350–900 нм не выявлены новые полосы поглощения электромагнитного излучения раствором метиленового синего в суперосновной среде.
Рисунок 2. Спектр поглощения 2 мл 4,5 мкМ раствора метиленового синего (кривая 1) и его эволюция (кривые 2–10) спустя 120 мин после добавления 10 мкл 3 мМ раствора гидроксида калия. Растворитель — диметилсульфоксид / © Юрий Б. Цаплев и др., Dyes and Pigments
«Совсем иной характер химического взаимодействия наблюдается, когда концентрация щелочи на порядок больше, чем красителя, — сообщил Алексей Трофимов, заместитель директора по науке ИБХФ РАН, доцент департамента молекулярной и биологической физики МФТИ. — Мы назвали этот процесс сверхстехиометрическим».
Поглощение излучения раствором метиленового синего в красной области спектра резко падает в ходе перемешивания реагентов. Затем длительное время в видимой области спектра видны, как минимум, пять пиков (Рисунок 3А). Они расположены в окрестностях длин волн 650, 620, 530, 440 и 420 нм. Интенсивность пиков максимальна непосредственно после смешения.
«Мы пришли к выводу, что неожиданно сложный спектр обязан своим происхождением неустойчивому продукту реакции метиленового синего со щелочью в суперстехиометрических условиях, — пояснил Алексей Трофимов. — Названное соединение образовалось при участии супероксида, который является промежуточным звеном в реакционной среде».
На образование этого продукта указывают особенности флуоресценции изучаемой системы. Флуоресценция — это способность вещества поглощать свет на определенной длине волны и через некоторое время испускать его на большей длине волны. Спектры поглощения и возбуждения флуоресценции системы (Рисунки 3A и 3B) имеют сложную структуру и очень похожи. Максимум флуоресценции нового продукта реакции зафиксирован при длине волны 695 нм. Вместе с тем спектры флуоресценции обнаруженного соединения и метиленового синего существенно отличаются (Рисунок 3С).
Следует подчеркнуть, что ученые впервые определили достоверные значения коэффициентов экстинкции хлорида метиленового синего. Если растворитель — вода, то коэффициент экстинкции (л / (моль ∙ см)) раствора красителя составляет 86 000 ± 9 000 при длине волны 664 нм, если метанол, то 115 000 ± 6 000 при длине волны 653 нм, если диметилсульфоксид, то 96 000 ± 7 000 при длине волны 671 нм. Под экстинцией понимают ослабление светового пучка в ходе его распространения в среде за счет поглощения света.
Дальнейшие исследования позволят ученым прояснить механизм новой реакции, приводящей к образованию загадочного неустойчивого соединения, и расширить сферу применения метиленового синего.