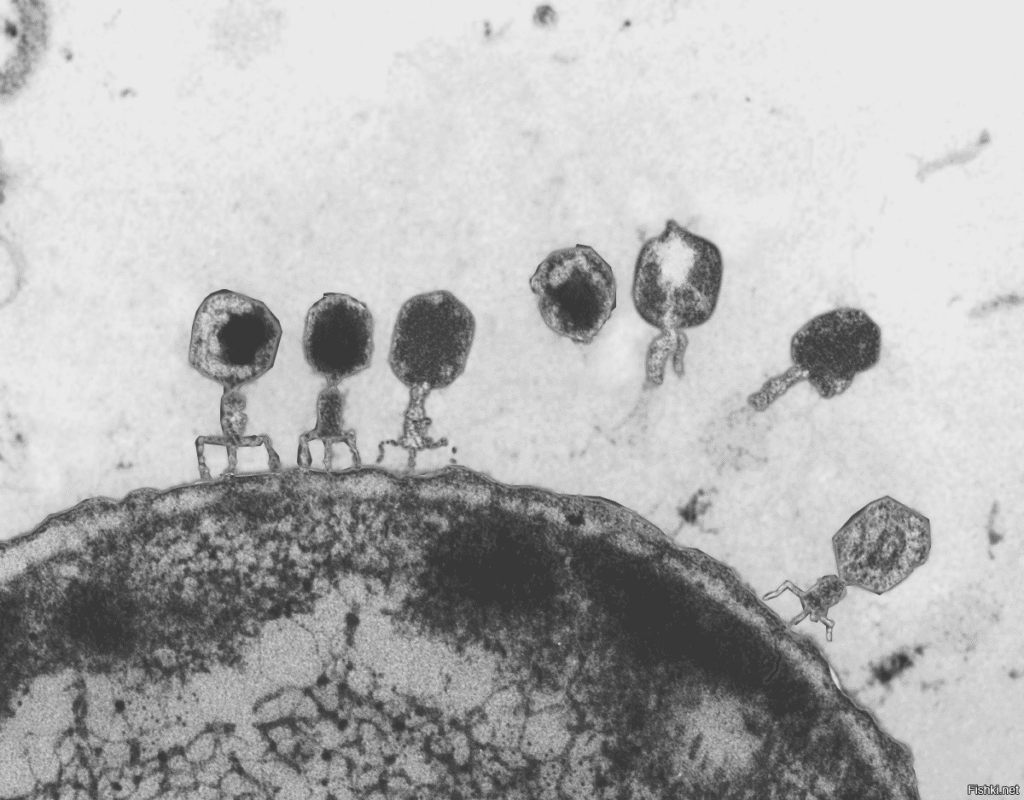
Сегодня любой старшеклассник имеет хотя бы базовое представление о том, что такое гены, как устроена ДНК, как она копируется и каким образом с нее считывается информация. Можно сказать, что современная молекулярная биология смогла проникнуть в саму суть жизни.
Однако мало кто задумывается над тем, как ученые обо всем этом узнали. Изучать такие процессы на клетках человека и других высокоорганизованных организмов крайне сложно. Тут нужны простые модельные системы. В прошлом столетии ими стали бактериофаги – вирусы, паразитирующие на бактериях.
Невидимые помощники биологов
Фаговая частица устроена элементарно: ДНК и белковая оболочка. Генов в них немного, изучать их просто, а при необходимости можно получить огромное количество копий. Именно благодаря этим микроскопическим «инопланетянам», а также полету научной мысли и серии элегантных экспериментов, стали известны многие подробности работы генов в организме человека.
В России благодаря многолетней клинической практике бактериофаги хорошо известны, прежде всего, как антибактериальные препараты. Компания НПО «Микроген» (входит в холдинг «Нацимбио» Госкорпорации Ростех) единственная в мире производит их в промышленных масштабах, посвящает много ресурсов для их исследований и даже создала первый в России Биоресурсный центр. На базе этой структуры сформирован фонд бактериофагов, циркулирующих на территории России.
Случайны ли мутации?
Могут ли мутации в живых клетках возникать случайно, или для этого обязательно нужны ультрафиолетовые лучи, радиация, вирусы, токсины либо иные факторы? Сегодня ответы на эти вопросы входя в школьную программу обучения, когда-то этого не мог сказать ни один из светил науки.
При этом найти ответы было крайне важно, ведь от этого зависело понимание работы генов, наследственности и теории эволюции. Решение было обнаружено в 1943 году (когда даже еще никто не знал, как устроена ДНК!) двумя талантливыми американскими учеными — микробиологом Сальвадором Лурия и биофизиком Максом Дельбрюком. За свое открытие они получили Нобелевскую премию, а помогли им в этом бактериофаги.
К 1943 году ученые уже знали, что бактерии могут очень быстро становиться устойчивыми к фагам за счет мутаций. Пытаясь объяснить это явление, биологи того времени поделились на два лагеря. Одни считали, что фаги становятся своего рода «прививкой»: они сами же и вызывают мутации, за счет которых бактерии приобретают невосприимчивость к их потомкам. Другие утверждали, что мутации возникают спонтанно (случайным образом) еще до того, как микроорганизмы встретятся с фагами.
Когда Лурия и Дельбрюк впервые попытались проверить эти гипотезы, их ожидало разочарование: мутации в бактериях возникали настолько хаотично, что разобраться в них было совершенно невозможно. Дальше все происходило по сюжету хорошего голливудского фильма. Помогла случайность: однажды Лурия наблюдал, как его коллега выиграл три доллара на игровом автомате и получил приз десятицентовыми монетами. В голове ученого вспыхнула ассоциация, и он понял, что нужно посчитать число колоний с разными мутациями. Мутации, которые возникают чаще, скорее всего, происходят в самых ранних поколениях микроорганизмов (читайте: до встречи с вирусом).
Лурия поделился своей догадкой с Дельбрюком, и тот, чтобы ее проверить, задействовал всю мощь статистики. Гипотеза о том, что мутации возникают только под действием фагов, была опровергнута. Они появляются постоянно, а значит, ошибки при копировании генов могут происходить случайно. Главный двигатель эволюции не останавливается никогда.
Еще в середине позапрошлого столетия чешский монах и биолог Грегор Мендель доказал своими знаменитыми экспериментами с горохом, что живые организмы не наследуют признаки от родителей напрямую. Это происходит по определенным законам через некие субстраты — гены.
Где находится «код жизни»?
Но что есть гены? Ученые быстро поняли, что эти таинственные хранители наследственной информации находятся в хромосомах. Однако, и хромосомы не так просты: в них есть ДНК и белок. Сейчас это кажется удивительным, но до середины прошлого столетия ученые отдавали пальму первенства именно белкам. Таких взглядов придерживался и американский биолог Альфред Херши. Тем не менее он решил перепроверить свои догадки вместе с ботаником Марком Чейзом. Они провели эксперименты с бактериями и фагами, впоследствии ставшие легендарными.
Ученые знали, что бактериофаги прикрепляются к клетке-хозяину и вводят в нее какое-то вещество – ДНК или белок. Это вещество и становилось инструкцией для синтеза и сборки новых фаговых частиц. Чтобы понять, что именно вводит фаг в бактерию, исследователи вывели две разновидности фагов. Одни производились в присутствии радиоактивного изотопа серы 35S. Сера присутствует в составе белков, но ее нет в ДНК. Таким образом, «помеченным» оказался только белковый компонент фаговых частиц. Вторую популяцию бактериофагов выводили в присутствии радиоактивного изотопа фосфора 32P. Он, наоборот, входит только в состав ДНК.
Отдельные культуры бактерий заражали разными фагами, а потом загружали в блендер и хорошенько взбалтывали, чтобы очистить от свободных вирусов. Затем образцы центрифугировали, и в итоге на дне, в осадке, оставались только бактерии, а в бульоне – только остатки фагов. Когда же Херши и Чейз провели анализ, то увидели, что в осадке, там, где бактерии, много 32P. А значит, фаги вводят в них именно ДНК. Получается, именно там все это время прятался от ученых «код жизни».
Сколько «букв» в «слове» генетического кода?
30 декабря 1961 года в журнале Nature была опубликована статья под названием «Общая природа генетического кода белков», которая вскоре превратилась в классику молекулярной биологии и была объявлена «одной из самых замечательных работ по биологии». Впоследствии другие ученые процитировали ее в своих трудах более 900 раз. Так чем же авторы этой публикации – молекулярный биолог Фрэнсис Крик, биолог Сидней Бреннер и двое их коллег – сумели так поразить научный мир?
К моменту выхода этой статьи ученым было известно, что ДНК состоит из четырех видов азотистых оснований («букв» генетического кода), а белки – из 20 видов аминокислот. Нехитрые подсчеты подсказывали, что только одно азотистое основание не может кодировать одну аминокислоту – на всех не хватит. Недостаточно и «слов» из двух азотистых оснований: получается 16 разных сочетаний, всё еще меньше, чем число аминокислот. А вот «слова» из трех «букв» вполне подходят. 64 возможные сочетания с лихвой перекрывают все аминокислотное разнообразие. В теории логично, но на практике никто этого доказать не мог.
Долгожданное свидетельство удалось обнаружить Фрэнсису Крику с коллегами в 1961 году. Учены рассуждали так. Если «вырезать» из ДНК одну «букву», то генетический код станет бессмысленным, потому что сдвинется вся рамка считывания. Например, есть код ААТ ГЦА ААА ТЦГ. Удалим из него первую «букву» и получим АТГ ЦАА ААТ ЦГ. То есть все последующие «слова» тоже сдвинулись, и получился совершенно иной ген.
Проверить гипотезу решили на фагах T4. В них вызывали мутации с помощью соединения под названием профлавин – он как раз приводит к удалению отдельных «букв» генетического кода или вставкам лишних. Оказалось, что если удалить только одну или две «буквы», то ген перестает работать, читается совершенно неправильно, и из-за этого фаг больше не может инфицировать бактерию. Но если добавить или удалить сразу три «буквы», то структура белка почти не меняется, и он по-прежнему работает. Так было доказано, что каждая аминокислота кодируется сочетанием трех азотистых оснований – триплетом. Важность этого открытия для всего последующего развития молекулярной биологии и генетики сложно переоценить.
Переносчики ДНК
В 1958 американский генетик и биохимик Джошуа Ледерберг получил Нобелевскую премию за то, что открыл конъюгацию – «бактериальный секс». Ученый обнаружил, что бактериальные клетки могут напрямую обмениваться между собой генетическим материалом, и это играет важную роль в их эволюции.
Ледерберг использовал в своих экспериментах кишечные палочки, а позже его работу продолжил биолог Нортон Зиндер. Он решил проверить, как работает конъюгация в сальмонеллах – возбудителях кишечной инфекции. Зиндер взял два штамма микроорганизмов, неспособных синтезировать некоторые соединения, и выращивал их в среде, бедной питательными веществами, да еще и с пенициллином.
Выжить должны были только самые приспособленные, благодаря новым мутациям. Но фокус, прежде сработавший с кишечными палочками, с сальмонеллами не прошел. Удалось получить лишь один штамм, в котором появились мутанты, способные синтезировать для себя все необходимые вещества.
Впрочем, даже такой небольшой успех на первый взгляд обернулся поражением. Анализ показал, что новый мутантный штамм получился без «бактериального секса». Но ученые не опустили рук и продолжили изыскания. Они предположили: если конъюгация тут ни при чем, значит, должен работать другой механизм. И действительно, вскоре он обнаружился: оказалось, что мутантными генами сальмонелл наделили бактериофаги.
Так в 1966 году была открыта фаговая трансдукция. Эта суперспособность вирусов делает их отличными переносчиками генетического материала, что весьма полезно в генной инженерии. С помощью фагов в бактерии можно загрузить определенный ген, и они станут производить необходимое соединение.
«Ножницы» для генов
Косвенно бактериофаги подарили современным ученым простой, быстрый и очень эффективный способ редактирования генов. Без него генная инженерия вряд ли смогла бы достичь таких внушительных успехов. Все началось еще в 1987 году, когда японский ученый Йошизуми Ишино случайно обнаружили в ДНК кишечных палочек странные участки, где находились повторяющиеся последовательности, прерывающиеся уникальными.
Никаких белков эти последовательности не кодируют, и сначала исследователи подумали, что это не более чем «генетический мусор». Однако, позже таинственные последовательности были обнаружены и у других бактерий. Их назвали короткими палиндромными повторами, регулярно расположенными группами, сокращенно CRISPR. Долгое время считалось, что это какая-то система репарации («починки») поврежденной ДНК. Но в 2000 году обнаружилось, что в CRISPR на самом деле содержатся фрагменты генов бактериофагов. Так ученые поняли, что у бактерий есть собственная «иммунная система».
Работает этот защитный механизм так. После того как тот или иной фаг побывал в бактериальной клетке, она может сохранить фрагмент ДНК возбудителя и включить его в CRISPR. На матрице этой ДНК синтезируется молекула РНК. Последняя плавает внутри клетки и, как полицейский с ориентировкой, отслеживает «знакомые» фаговые гены. Как только они обнаруживаются, активируется фермент-нуклеаза Cas и буквально разрезает вирусную ДНК. Эта защитная система получила название CRISPR-Cas. Она чем-то напоминает антитела в организме человека: они тоже умеют специфически распознавать чужеродные частицы.
Изучать гонку вооружений между бактериями и фагами, конечно, интересно, но для системы CRISPR-Cas нашлось и практическое применение. В 2012 году ученые придумали, как ее использовать для разрезания генов любых организмов в любых местах. Новый способ оказался намного быстрее и эффективнее, чем применявшиеся ранее. Система CRISPR-Cas сейчас используется для создания генетически-модифицированных организмов, производства лекарств, генетической диагностики. Она имеет потенциал и для лечения генетических заболеваний, таких как серповидно-клеточная немия, муковисцидоз.